
- •Курс лекций
- •Содержание
- •Введение
- •1 Механическое движение и его виды
- •1 Механическое движение и его виды
- •2 Кинематика поступательного движения
- •3 Кинематика вращательного движения
- •4 Связь между угловыми и линейными величинами
- •Контрольные вопросы
- •1 Динамические характеристики поступательного движения
- •2 Законы Ньютона
- •3 Динамические характеристики вращательного движения
- •Моменты инерции некоторых тел
- •4 Основной закон динамики вращательного движения
- •5 Аналогия формул поступательного и вращательного движений
- •Основные характеристики и формулы кинематики
- •Контрольные вопросы
- •1 Понятие симметрии. Теорема Нетер
- •2 Закон сохранения импульса
- •3 Момент импульса. Закон сохранения момента импульса
- •4 Работа, мощность, энергия
- •5 Закон сохранения энергии
- •Контрольные вопросы
- •1 Принципы относительности Галилея и Эйнштейна
- •2 Понятие о специальной теории относительности
- •3 Основной закон релятивисткой динамики материальной точки
- •4 Закон взаимосвязи массы и энергии
- •Контрольные вопросы
- •Молекулярно-кинетическая теория идеальных газов
- •1 Основные положения молекулярно – кинетической теории
- •2 Опытные законы идеального газа. Уравнение состояния
- •3 Основное уравнение молекулярно-кинетической теории идеальных газов
- •4 Распределение Максвелла
- •5 Барометрическая формула. Распределение Больцмана
- •Контрольные вопросы
- •Основы равновесной термодинамики
- •1 Внутренняя энергия тела и идеального газа
- •2 Работа газа при изменении его объема
- •3 Первое начало термодинамики
- •4 Второе начало термодинамики
- •5 Тепловые двигатели и их кпд
- •Контрольные вопросы
- •Элементы неравновесной термодинамики
- •1 Энтропия как мера беспорядка в системе. Статистический смысл второго начала термодинамики
- •2 Третье начало термодинамики
- •3 Изменение энтропии в открытых системах
- •4 Понятие о самоорганизации
- •5 Примеры самоорганизации в природе
- •Контрольные вопросы
- •Сформулируйте расширенный вариант второго закона термодинамики для открытых систем.
- •Электростатическое поле
- •2 Электростатическое поле и его характеристики
- •3 Теорема Гаусса для электростатического поля в вакууме
- •4 Циркуляция вектора напряженности электростатического поля
- •6 Энергия электростатического поля
- •Контрольные вопросы
- •1 Магнитное поле
- •2 Силы Ампера и Лоренца
- •3 Закон Био – Савара – Лапласа. Простейшие случаи расчета магнитных полей
- •4 Работа по перемещению проводника с током в магнитном поле
- •Контрольные вопросы
- •1 Явление электромагнитной индукции
- •Явления самоиндукции и взаимной индукции
- •3 Магнитное поле в веществе
- •4 Теорема о циркуляции для магнитного поля
- •5 Энергия магнитного поля
- •Контрольные вопросы
- •2 Ток смещения
- •3 Уравнение Максвелла для электромагнитного поля
- •Контрольные вопросы
- •1 Свободные гармонические колебания
- •1 Свободные гармонические колебания
- •2 Затухающие и вынужденные колебания
- •3 Волны
- •4 Электромагнитные волны
- •Контрольные вопросы
- •Волновые свойства электромагнитного излучения
- •1 Развитие представлений и природе света
- •2 Интерференция света и методы ее наблюдения
- •1 Метод Юнга
- •2 Зеркало Ллойда
- •3 Интерференция в тонких пленках
- •3 Дифракция электромагнитных волн
- •4 Поляризация света
- •Контрольные вопросы
- •Квантовые свойства электромагнитного излучения
- •1 Тепловое излучение. Гипотеза Планка
- •2 Фотоэффект и его применение
- •3 Давление света. Фотоны
- •4 Эффект Комптона
- •5 Единство волновых и корпускулярных свойств электромагнитного излучения
- •Контрольные вопросы
- •1 Гипотеза де Бройля. Корпускулярно волновой дуализм как универсальное свойство материи
- •2 Соотношение неопределенностей
- •3 Волновая функция и ее статистический смысл
- •4 Уравнение Шредингера и его решения для ряда простейших случаев
- •1 Движение свободной частицы
- •2 Частица в одномерной прямоугольной «потенциальной яме» с бесконечно высокими стенками
- •Контрольные вопросы
- •1 Развитие представлений о строении атома
- •2 Атом водорода в квантовой механике
- •3 Многоэлектронные атомы
- •4 Атомное ядро
- •5 Радиоактивность. Радиоактивные излучения
- •Контрольные вопросы
- •Современная физическая картина мира
- •1 Агрегатные состояния вещества
- •2 Кристаллы и их симметрия. Дефекты в кристаллах
- •3 Понятие о зонной теории твердых тел
- •4 Проводимость твердых тел. Проводники, полупроводники и диэлектрики
- •Контрольные вопросы
- •2 Частицы и античастицы
- •3 Элементарные частицы и их классификация. Понятие о кварках
- •1 Основные типы физических взаимодействий в природе
- •2 Частицы и античастицы
- •3 Элементарные частицы и их классификация. Понятие о кварках
- •4 Современная физическая картина мира
- •Контрольные вопросы
- •Заключение
- •Библиографический список
- •Перечень ключевых слов
2 Работа газа при изменении его объема
При любых изменениях объема газа совершается работа А, при этом справедливо выражение
 , (6.5)
, (6.5)
Результат интегрирования определяется характером зависимости между давлением и объемом системы. Работа может быть как положительной, так и отрицательной:
А > 0 при совершении работы самой системой;
A < 0 при совершении работы внешними силами над системой;
Произведенную работу можно изобразить графически с помощью кривой зависимости p=f(V) в координатах p,V (рисунок 7). Работа расширения газа от объема V1 до объема V2 определяется площадью, ограниченной осью абсцисс, кривой p=f(V) и прямыми V1 и V2. (площадью заштрихованной криволинейной трапеции).
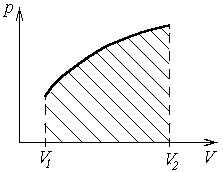
Рисунок 7 – Графическое определение работы газа
Вычислим работу газа в изопроцессах:
1. Изобарический процесс (p=const)
 (6.6)
(6.6)
2. Изохорный процесс (V=const)
A=0
3. Изотермический процесс (T=const)
 . (6.7)
. (6.7)
При
получении выражения (6.7) мы использовали
уравнение Менделеева −Клапейрона в
виде
![]() .
.
3 Первое начало термодинамики
Внутренняя энергия системы может изменяться за счет в основном двух различных процессов: совершения над системой работы A1 и сообщения ей количества теплоты Q. Совершение над системой работы сопровождается перемещением внешних тел, воздействующих на систему. Так, например, при вдвигании поршня, закрывающего сосуд с газом, поршень, перемещаясь, совершает над газом работу A1. По третьему закону Ньютона газ при этом совершает над поршнем работу A=–A1. Сообщение системе тепла не связано с перемещением внешних тел и с совершением над системой макроскопической работы. В этом случае изменение внутренней энергии обусловлено тем, что отдельные молекулы более нагретого тела совершают работу над отдельными молекулами менее нагретого тела. Передача энергии при этом также происходит через излучение. Совокупность таких микроскопических процессов называется теплопередачей.
Первое начало термодинамики представляет собой закон сохранения энергии для термодинамических процессов: теплота, переданная системе, расходуется на увеличение ее внутренней энергии и на совершение ею работы против внешних сил.
Q = U+A. (6.8)
Применим первое начало термодинамики к известным нам процессам.
Изобарический процесс (p=const) : Q = U+A.
Изохорический процесс (V=const) Q =U
Изотермический процесс (T=const) Q = A
Адиабатический процесс (Q=0) A = –U
4 Второе начало термодинамики
Для описания термодинамических процессов недостаточно первого начала термодинамики, выражающего закон сохранения энергии, но не определяющего направление протекания процессов в природе. Можно представить множество процессов, не противоречащих первому началу, но никогда не происходящих в природе.
В формулировке Р. Клаузиуса содержание второго начала термодинамики выглядит следующим образом: теплота никогда не может переходить сама собой от тел с более низкой температурой к телам с более высокой температурой.
Существуют ряд других формулировок второго начала, для понимания которых необходимы дополнительные сведения. Эти сведения будут изложены в следующей лекции. Второе начало термодинамики устанавливает наличие в природе фундаментальной асимметрии, т.е. однонаправленности всех самопроизвольных процессов. Количество энергии в замкнутых системах сохраняется, однако распределение энергии меняется необратимым образом.
