
- •Курс лекций
- •Содержание
- •Введение
- •1 Механическое движение и его виды
- •1 Механическое движение и его виды
- •2 Кинематика поступательного движения
- •3 Кинематика вращательного движения
- •4 Связь между угловыми и линейными величинами
- •Контрольные вопросы
- •1 Динамические характеристики поступательного движения
- •2 Законы Ньютона
- •3 Динамические характеристики вращательного движения
- •Моменты инерции некоторых тел
- •4 Основной закон динамики вращательного движения
- •5 Аналогия формул поступательного и вращательного движений
- •Основные характеристики и формулы кинематики
- •Контрольные вопросы
- •1 Понятие симметрии. Теорема Нетер
- •2 Закон сохранения импульса
- •3 Момент импульса. Закон сохранения момента импульса
- •4 Работа, мощность, энергия
- •5 Закон сохранения энергии
- •Контрольные вопросы
- •1 Принципы относительности Галилея и Эйнштейна
- •2 Понятие о специальной теории относительности
- •3 Основной закон релятивисткой динамики материальной точки
- •4 Закон взаимосвязи массы и энергии
- •Контрольные вопросы
- •Молекулярно-кинетическая теория идеальных газов
- •1 Основные положения молекулярно – кинетической теории
- •2 Опытные законы идеального газа. Уравнение состояния
- •3 Основное уравнение молекулярно-кинетической теории идеальных газов
- •4 Распределение Максвелла
- •5 Барометрическая формула. Распределение Больцмана
- •Контрольные вопросы
- •Основы равновесной термодинамики
- •1 Внутренняя энергия тела и идеального газа
- •2 Работа газа при изменении его объема
- •3 Первое начало термодинамики
- •4 Второе начало термодинамики
- •5 Тепловые двигатели и их кпд
- •Контрольные вопросы
- •Элементы неравновесной термодинамики
- •1 Энтропия как мера беспорядка в системе. Статистический смысл второго начала термодинамики
- •2 Третье начало термодинамики
- •3 Изменение энтропии в открытых системах
- •4 Понятие о самоорганизации
- •5 Примеры самоорганизации в природе
- •Контрольные вопросы
- •Сформулируйте расширенный вариант второго закона термодинамики для открытых систем.
- •Электростатическое поле
- •2 Электростатическое поле и его характеристики
- •3 Теорема Гаусса для электростатического поля в вакууме
- •4 Циркуляция вектора напряженности электростатического поля
- •6 Энергия электростатического поля
- •Контрольные вопросы
- •1 Магнитное поле
- •2 Силы Ампера и Лоренца
- •3 Закон Био – Савара – Лапласа. Простейшие случаи расчета магнитных полей
- •4 Работа по перемещению проводника с током в магнитном поле
- •Контрольные вопросы
- •1 Явление электромагнитной индукции
- •Явления самоиндукции и взаимной индукции
- •3 Магнитное поле в веществе
- •4 Теорема о циркуляции для магнитного поля
- •5 Энергия магнитного поля
- •Контрольные вопросы
- •2 Ток смещения
- •3 Уравнение Максвелла для электромагнитного поля
- •Контрольные вопросы
- •1 Свободные гармонические колебания
- •1 Свободные гармонические колебания
- •2 Затухающие и вынужденные колебания
- •3 Волны
- •4 Электромагнитные волны
- •Контрольные вопросы
- •Волновые свойства электромагнитного излучения
- •1 Развитие представлений и природе света
- •2 Интерференция света и методы ее наблюдения
- •1 Метод Юнга
- •2 Зеркало Ллойда
- •3 Интерференция в тонких пленках
- •3 Дифракция электромагнитных волн
- •4 Поляризация света
- •Контрольные вопросы
- •Квантовые свойства электромагнитного излучения
- •1 Тепловое излучение. Гипотеза Планка
- •2 Фотоэффект и его применение
- •3 Давление света. Фотоны
- •4 Эффект Комптона
- •5 Единство волновых и корпускулярных свойств электромагнитного излучения
- •Контрольные вопросы
- •1 Гипотеза де Бройля. Корпускулярно волновой дуализм как универсальное свойство материи
- •2 Соотношение неопределенностей
- •3 Волновая функция и ее статистический смысл
- •4 Уравнение Шредингера и его решения для ряда простейших случаев
- •1 Движение свободной частицы
- •2 Частица в одномерной прямоугольной «потенциальной яме» с бесконечно высокими стенками
- •Контрольные вопросы
- •1 Развитие представлений о строении атома
- •2 Атом водорода в квантовой механике
- •3 Многоэлектронные атомы
- •4 Атомное ядро
- •5 Радиоактивность. Радиоактивные излучения
- •Контрольные вопросы
- •Современная физическая картина мира
- •1 Агрегатные состояния вещества
- •2 Кристаллы и их симметрия. Дефекты в кристаллах
- •3 Понятие о зонной теории твердых тел
- •4 Проводимость твердых тел. Проводники, полупроводники и диэлектрики
- •Контрольные вопросы
- •2 Частицы и античастицы
- •3 Элементарные частицы и их классификация. Понятие о кварках
- •1 Основные типы физических взаимодействий в природе
- •2 Частицы и античастицы
- •3 Элементарные частицы и их классификация. Понятие о кварках
- •4 Современная физическая картина мира
- •Контрольные вопросы
- •Заключение
- •Библиографический список
- •Перечень ключевых слов
3 Основное уравнение молекулярно-кинетической теории идеальных газов
Основное уравнение МКТ выводится для одноатомного идеального газа в предположении, что молекулы движутся хаотически, число столкновений молекул между собой пренебрежимо мало по сравнению с числом их ударов о стенки сосуда, а последние являются упругими. Вывод уравнения сделан еще в школьном курсе физики, уравнение имеет вид:
![]() (5.6)
(5.6)
где Р – давление идеального газа на стенку сосуда; n – концентрация (число молекул в единице объема) молекул газа; m – масса молекулы газа;
<υ2> - средняя квадратичная скорость молекул.
Сравнивая выражения (5.2) и (5.6) можно получить очень важное соотношение:
![]() (5.7)
(5.7)
где <Е> - средняя кинетическая энергия отдельной молекулы;
Из выражения (5.7) следуют важные выводы:
абсолютная температура является мерой кинетической энергии поступательного движения молекул;
абсолютному нулю температуры (0 К) отвечает равная нулю кинетическая энергия молекул.
4 Распределение Максвелла
Молекулы газа движутся хаотически. В результате многократных столкновений скорость каждой молекулы постоянно изменяется по величине и направлению. Однако, в состоянии равновесия в газе устанавливается некоторое стационарное (не меняющееся со временем) распределение молекул по скоростям.
Статистические методы позволяют найти функцию распределения молекул по скоростям, а также распределение числа молекул по кинетическим энергиям их беспорядочного теплового движения. Впервые это сделал К. Максвелл (1831 – 1879 г.г.), поэтому найденные им выражения называют функциями распределения Максвелла.
Максвелл ввел функцию f(u,T)
![]() (5.8)
(5.8)
где (dN/N) – относительное число молекул, скорости которых заключены в интервале (v, v+dv). Тогда (dN/(Ndv)) – относительное число молекул в указанном интервале скоростей, приходящееся на единичное значение этого интервала.
Применяя методы теории вероятностей, Максвелл нашел функцию f(v,T).
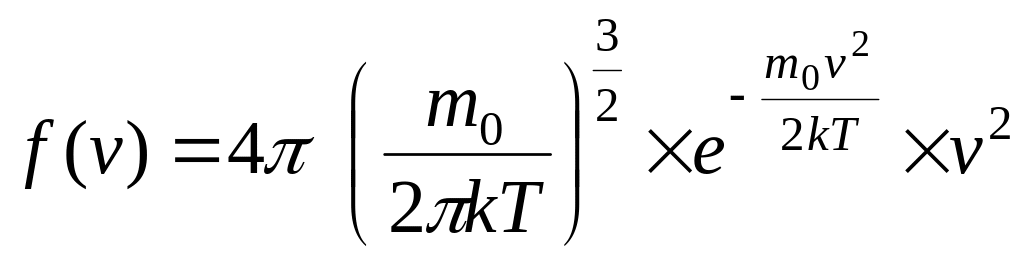 .
(5.9)
.
(5.9)
Функция f(v) представлена на рисунке 5.
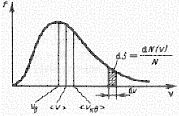
Рисунок 5 – Кривая распределения молекул по скоростям
Видно, что эта функция имеет максимум при определенной скорости vкв, которая называется наиболее вероятной. Значение наиболее вероятной скорости можно получить, исследуя функцию (5.9) на экстремум. Соответствующие вычисления приводят к следующему результату:
![]() (5.10)
(5.10)
Очевидно, что vкв. зависит от массы молекулы m0: более тяжелые молекулы при прочих равных условиях движутся медленнее. С повышением температуры средняя квадратичная скорость молекул возрастает (рисунок 6).
При этом доля молекул, обладающих этой скоростью, уменьшается. Площадь, ограниченная кривой распределения, остается неизменной (при повышении температуры кривая растягивается, значение максимума уменьшается). Это связано с тем, что площадь под кривой распределения характеризует общее число молекул N, которое остается неизменным.
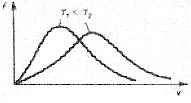
Рисунок 6 – Кривые распределения молекул по скоростям
при различных температурах
Закон Максвелла
о распределении молекул идеального
газа по скоростям можно представить
через энергии теплового движения
молекул. Пусть dN(ε)
– число молекул, имеющих кинетическую
энергию поступательного движения,
заключенную в интервале от
![]() до
до
![]() .
Тогда функция распределения молекул
по энергиям теплового движения
.
Тогда функция распределения молекул
по энергиям теплового движения
![]() имеет вид:
имеет вид:
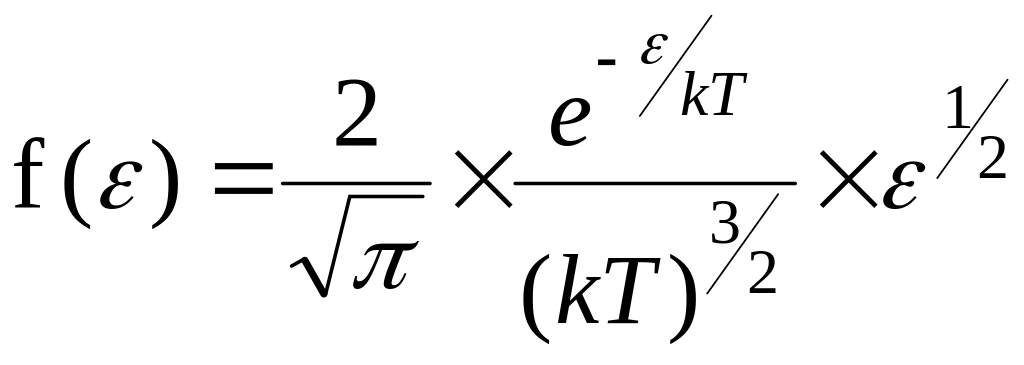 (5.11)
(5.11)
