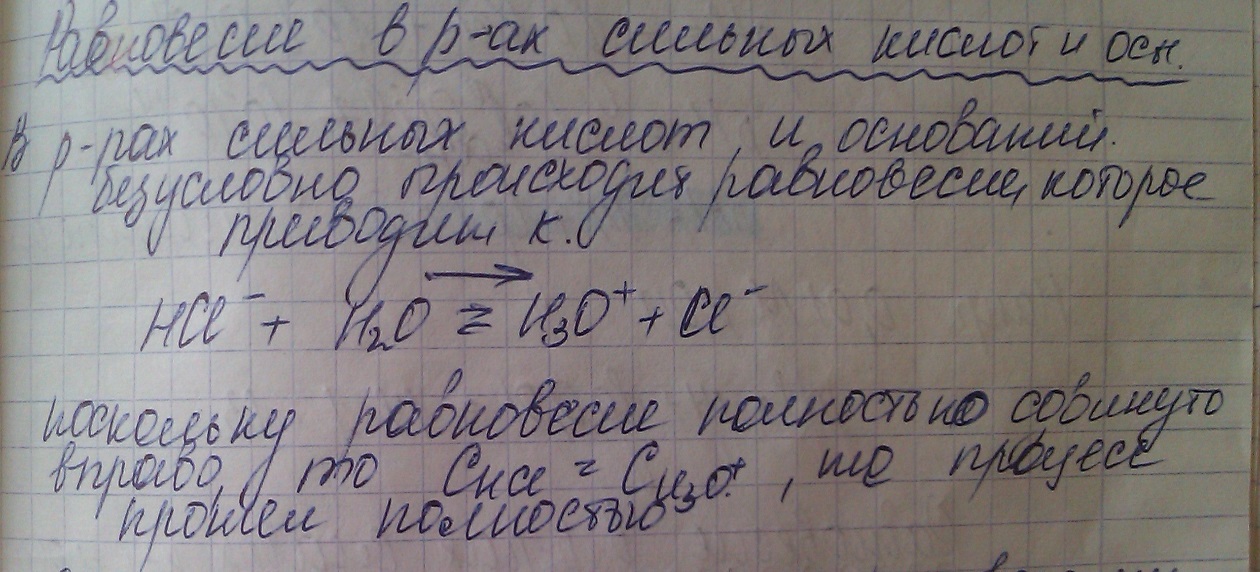- •Требования к аналитическим реакциям:
- •2) Вывод формулы для расчета Ph.
- •3) Степень гидролиза.
- •Метод обратного титрования
- •48. Гравиметрическое определение железа, основные этапы анализа, реакции, лежащие в основе метода, осаждаемая и весовая формы (требования). Расчетная формула результатов анализа.
- •49. Осадительное титрование. Определение содержания хлоридов в растворе методом Фольгарда. Условия проведения титрования. Реакции, лежащие в основе метода, индикаторы, расчетные формулы.
- •50. Осадительное титрование. Определение содержания хлоридов в растворе методом Мора. Условия проведения титрования. Реакции, лежащие в основе метода, индикаторы, расчетные формулы.
Дробный ход анализа – анализ соответствующих ионов из отдельных порций растворов с использованием специальных реакций.
Систематический ход анализа – это прием (или серия) согласно которому предварительно обнаруживается и выводится из раствора отдельные группы ионов, после чего анализ проводится только в этих группах.
Групповой реагент – такой реагент, который переводит в осадок или выделяет из раствора целую группу катионов. Он используется для проведения систематического анализа вещества.
Схема анализа по кислотно-щелочной классификации:
Анализ начинается со второй группы.
Сначала отделяем 2 и 3 группы аналогично.
Делим анализ по 2-м свойствам:
Амфотерные вещества – 5 группа
Комплексообразующие – 6 группа
К раствору имеющему 4-6 группу добавляют избыток щелочи. 4 группа в растворе, а 5, 6 – в осадке.
К осадку 5,6 групп добавляем раствор аммиака. 6 группа – в растворе, в виде аммиакатов, [Cu(NH3)4]2+ - раствор, 5 группа в осадке.
Наличие ионов первой группы определяется специальными реакциями. Если реакция с групповыми реагентами не дали результатов.
Схема анализа неизвестного вещества:
Для начала проделываются все реакции с групповыми реагентами. После нахождения определенной реакции на него, а именно, появление осадка, мы делаем качественные реакции на отдельные ионы, к группе которого они принадлежат.
Схема анализа неизвестного вещества:
Для начала проделываются все реакции с групповыми реагентами. После нахождения определенной реакции на него, а именно, появление осадка, мы делаем качественные реакции на отдельные ионы, к группе которого они принадлежат.
Систематический ход анализа – это прием (или серия) согласно которому предварительно обнаруживается и выводится из раствора отдельные группы ионов, после чего анализ проводится только в этих группах.
Групповой реагент – такой реагент, который переводит в осадок или выделяет из раствора целую группу катионов. Он используется для проведения систематического анализа вещества.
Схема анализа по сероводородной классификации:
Анализ начинается с конца.
Определяем ионы с помощью дробных реакций: NH4+, Fe2+, Fe3+;
С конц. HCl в осадок выпадает 5 группа.
С H2S (Na2S + H2O = H2S + 2NaOH + H+) в осадок выпадает 4 группа. В дальнейшем осадок анализируем по схеме с (NH4)2S, а оставшийся р-р содержит 1,2, 3 группы.
Доводим pH до 9
Добавляем (NH4)2S. 3 Группа выпадает в осадок (слабосульфидный либо гидроксильный)
Al2S3 + H2O = Al(OH)3 + H2S – гидролиз.
Добавляем карбонат аммония и отделяем в осадок 2 – ю группу, осадок растворяем в уксусной кислоте.
K и Na определяют микрокристаллоскопическим способом.
Требования к аналитическим реакциям:
Наличие легко наблюдаемого эффекта:
Железо 3-х вал. С роданид анионом – красное окрашивание.
Барий и анион угольной кислоты – осадок.
Хлорид алюминия и аммиак – растворение осадка.
Реакция должна протекать быстро.
Реакция должна быть практически необратима.
Реакция должна быть чувствительной. ( Чувствительность – возможность четко зафиксировать эффект)
Требования к реагентам:
Реагенты должны быть приготовлены правильно
Они должны быть химически чистыми
Если реагент групповой то:
Должен осаждать группу практически полностью= количественно.
Полученный осадок должен, в последствии, легко растворяться в кислотах, щелочах и прочем, для дальнейшего анализа.
Избыток группового реагента не должен мешать последующим определениям ионов.
Дробный ход анализа – анализ соответствующих ионов из отдельных порций растворов с использованием специальных реакций.
Систематический ход анализа – это прием (или серия) согласно которому предварительно обнаруживается и выводится из раствора отдельные группы ионов, после чего анализ проводится только в этих группах.
Когда имеем раствор основания B, то в нем устанавливается равновесие:
B + H2O = A + OH
Характеризующееся константой основности;
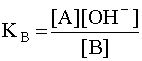
Чем больше численное значение константы основности, тем это основание сильнее и тем слабее сопряженная с ним кислота. В справочной литературе обычно приводятся только константы кислотности, но поскольку для любой сопряженной кислотно-основной пары произведение константы кислотности на константу основности есть величина постоянная, равная ионному произведению воды
![]()
Сильное основание:
КОН.
KOH = K++OH-
COH-=CKOH
Kw= [OH-] [H+] [H+] = Kw/ [OH-]
pH = -Lg Kw/ [OH-] = -Lg [H+]
pH = -Lg Kw + Lg [OH-]
pH = Lg Cосн – Lg 10-14
pH = 14 + Lg Cосн
Слабое основание:

Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.

Степенью диссоциации (ионизации) электролита называется отношение числа молекул, распавшихся на ионы, к общему числу его молекул, введенных в ра–створ.
Для оснований вычисляется формулой:
α =
 * 100 %
* 100 %
Кислоты — химические соединения, способные отдавать катион водорода
По силе
Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3);
Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Для кислот она именуется как константа кислотности.
B + H2O = A + H
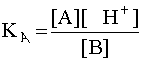
Степенью диссоциации (ионизации) электролита называется отношение числа молекул, распавшихся на ионы, к общему числу его молекул, введенных в ра–створ.
Для кислот вычисляется формулой:
α =
 * 100 %
* 100 %
Кислотный показатель — это рН растворов, солей, кислот, он показывает кислотность, т.е. содержание Н+ в растворе.
Вывод формул для слабых кислот на следующей странице


Когда имеем раствор основания B, то в нем устанавливается равновесие:
B + H2O = A + OH
Характеризующееся константой основности; Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия.
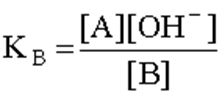
Чем больше численное значение константы основности, тем это основание сильнее и тем слабее сопряженная с ним кислота. В справочной литературе обычно приводятся только константы кислотности, но поскольку для любой сопряженной кислотно-основной пары произведение константы кислотности на константу основности есть величина постоянная, равная ионному произведению воды
![]()
Основание — это химическое соединение, способное образовывать ковалентную связь с протоном. Сильное основание: КОН, слабое основание: NH3 * H2O.
Сильное основание:
КОН.
KOH = K++OH-
COH-=CKOH
Kw= [OH-] [H+] [H+] = Kw/ [OH-]
pH = -Lg Kw/ [OH-] = -Lg [H+]
pH = -Lg Kw + Lg [OH-]
pH = Lg Cосн – Lg 10-14
pH = 14 + Lg Cосн
Степень диссоциации для сильных кислот и оснований равна 1.
Кислоты — химические соединения, способные отдавать катион водорода
По силе
Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3);
Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Для кислот она именуется как константа кислотности.
B + H2O = A + H
Степенью диссоциации (ионизации) электролита называется отношение числа молекул, распавшихся на ионы, к общему числу его молекул, введенных в ра–створ.
Для кислот вычисляется формулой:
α = * 100 %
Кислотный показатель — это рН растворов, солей, кислот, он показывает кислотность, т.е. содержание Н+ в растворе.
В растворе сильных кислот pH вычисляется следующим образом:
pH = - Lg Cк-ты.
Вопрос №9
1) Гидролизом солей называется обменная реакция взаимодействия ионов соли с водой с образованием малодиссоциированных соединений и сопровождающаяся изменением ионного равновесия воды, что отражается на характере среды.
Гидролиз солей является обратимой химической реакцией. Количественными характеристиками его являются степень гидролиза η и константа гидролиза. Степень гидролиза соли выражается отношением числа гидролизованных молекул к общему числу молекул соли в растворе. Степень гидролиза увеличивается с повышением температуры и разбавлением.
Гидролизу подвергаются соли, образованные: а) сильным основанием и слабой кислотой; б) сильной кислотой и слабым основанием; в) слабым основанием и слабой кислотой.
Гидролиз солей, образованных сильной кислотой и слабым основанием протекает всегда по катиону, заряд которого определяет число теоретических ступений гидролиза. Реакция среды их водных растворов кислая (рН < 7). NH4Cl=NH4+Cl; NH4+2H2O=NH4OH+H3O
NH4
+ H2O=NH4OH+H(+) [H2O]*Kp=
Kгидр=Kp[H2O]
 =
=