
- •44. Термодинаміка і статистична фізика. Два методи вивчення властивостей макроскопічних систем.
- •45. Ідеальний газ. Рівняння стану ідеального газу.
- •46.Перший принцип термодинаміки і його застосування.
- •47. Другий принцип(закон) термодинаміки
- •48. Друге начало для рівноважних процесів. Ентропія і термодинамічна температура.
- •49. Основне рівняння і основна нерівність термодинаміки. Цикл Карно і теорема Карно
- •50. Третій закон термодинаміки
- •51. Термодинамічні потенціали
- •Внутрішню енергія
- •2. Вільна енергія
- •3. Ентальпія (або теплова функція)
- •4. Термодинамічний потенціал Гіббса
- •52. Умови рівноваги і стійкості, принцип ле – шательє.
- •53. Основи термодинамічної теорії необоротних процесів. Співвідношення взаємності Онсагера.
- •54. Фазовий простір і його властивості. Макро- і мікроканонічні стани речовини
- •55.Розподіл молекул за швидкостями
- •56.Канонічний розподіл Гіббса
- •57. Рівняння Максвела – Больцмана
- •59. Розподіл Фермі-Дірака і його застосування
- •60.Розподіл Бозе-Енштейна і його застосування до випромінювання.Формула Планка
- •61.Теплоємність твердих тіл. Закон Дебая.
- •62. Флуктуаційні процеси. Елементи теорії флуктуації. Метод кореляції. Флуктуація густини.
- •63. Броунівський рух
- •64. Рівняння Фоккера-Планка
49. Основне рівняння і основна нерівність термодинаміки. Цикл Карно і теорема Карно
Сформулюємо друге начало термодинаміки для нерівних (необоротних) процесів. Розглянемо перехід системи з стану 1 в стан2.
Для переходу
необхідно: ![]() =dU+δ
=dU+δ![]() (1)
(1)

 1
Рівноважний перехід з стану 2 в стан
1 потребує затрати
1
Рівноважний перехід з стану 2 в стан
1 потребує затрати
δ![]() енергії.
енергії.
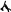 δQ
= dU + δW (2)
δQ
= dU + δW (2)
 δQ
Знайдемо різницю:
δQ
Знайдемо різницю:
2 δ – δQ = δ – δW (3)
Вираз (3) повинен бути від’ємним, а це значить, що
δQ > і відповідно δW > δ . А, отже, можна записати, що
ТdS >![]() (4)
(4)
Звідси робимо висновок, що
dS > ![]()
Отже, зміна енергії
![]() -
- ![]() >
> ![]() (5) Дане співвідношення дозволяє зробити
висновки:
(5) Дане співвідношення дозволяє зробити
висновки:
Перехід системи з одного стану в інший, що здійснюється адіабатично рівноважно не може бути здійснений адіабатично нерівно важно і навпаки.
Для адіабатично нерівноважного процесу dS > 0, зміна енергії > 0 (
 -
-  > 0).
> 0).
Цей висновок про зростання енергії складає зміст другого начала термодинаміки для нерівноважних процесів, тобто, ентропію можна характеризувати як міру необоротності процесів у замкнутій системі.
Для нерівноважного колового процесу випливає нерівність Клаузтса
![]() < 0 (6)
< 0 (6)
Це також є виразом другого начала термодинаміки. Скористаємося виразом першого начала термодинаміки, об’єднане рівняння другого начала може бути записане так:
𝖳dS ≥ dU + ![]() (7)
(7)
Цикл Карно і теореми Карно
Стосовно ККД
теплових машин Карно встановив дві
теореми, які еквівалентні другому началу
термодинаміки. За визначенням ККД ζ=
![]() , де W – теплота, використана для виконання
корисної роботи, і згідно першого начала
термодинаміки W =
, де W – теплота, використана для виконання
корисної роботи, і згідно першого начала
термодинаміки W = ![]() =
= ![]() , а отже
, а отже
ζ= ![]() .
.
цикли Карно можна зображати графічно



 Т 1
Т 1
![]() 2 Корисна робота – це
площа циклу,
2 Корисна робота – це
площа циклу,
3 а вся затрачена теплота буде
4 відповідати площі 1,2,3,В,А.
Підрахуємо ККД для циклу, який
А в S складається із двох ізотерм 1-2,
3 -4
і двох адіабат 2-3 і 4-1.
-4
і двох адіабат 2-3 і 4-1.


 Т
1 2
Т
1 2
4 3
 S
S
Кількість теплоти, яка витрачається при переході з стану 1 в 2
![]() =
= ![]() (
(![]() )
)
![]() =
= ![]() (
).
Отже корисна робота W=
(
).
Отже корисна робота W=![]()
![]() .
.
ζ= ![]() =
= ![]() (8)
(8)
Отже, ККД визначається тільки температурами термовіддавача і термоприймача (перша теорема Карно).
ККД необоротної машини є меншим ККД оборотної (друга теорема Карно).
