
- •1.Испарение влаги и разложение карбонатов в доменной печи.
- •3. Закономерности углетермических восстановительных процессов
- •4. Фазовые равновесия в двухкомпонентных системах.
- •5.Энтропийный метод расчёта константы равновесия
- •7. Химическое равновесие и константа равновесия металлургических
- •9. Подвижность химического равновесия. Принцип Ле Шателье.
- •10. Восстановление окислов металлов с помощью со и н2
- •11. Закономерности восстановительных процессов в системах с
- •12. Основы теории окислительного рафинирования металлов от
- •13.Теоретические основы процессов раскисления стали
10. Восстановление окислов металлов с помощью со и н2
Восстановление оксидов металлов газами идет по реакциям:
![]()
![]()
В данном случае является неизвестным, т.е. неизвестными являются условия восстановления. Анализ можно выполнить, если сопоставить между собой две более простые реакции.


![]()
Итак, видим, что
![]() .
Чтобы реакция восстановления могла
идти вправо, необходимо, чтобы
было отрицательно. Это может быть
достигнуто, если
будет более отрицательно, чем величина
,
значит, у СО (Н2)
сродство к кислороду должно быть больше,
чем у металла.
.
Чтобы реакция восстановления могла
идти вправо, необходимо, чтобы
было отрицательно. Это может быть
достигнуто, если
будет более отрицательно, чем величина
,
значит, у СО (Н2)
сродство к кислороду должно быть больше,
чем у металла.
Рассмотрим три крайних случая восстановления оксидов металла газами в зависимости от соотношения между сродством металла к кислороду и сродством восстановителя СО (Н2)к кислороду.
1.Сродство у металла и СО(Н2) к кислороду примерно одинаковы.
Таким образом,
![]() ,
,
Значит
![]()
А т.к.
![]()
Тогда
![]() ,
а это значит, что в равновесной газовой
фазе содержание СО и СО2
примерно одинаково.
,
а это значит, что в равновесной газовой
фазе содержание СО и СО2
примерно одинаково.

В восстановительной газовой смеси содержание СО должно быть больше, чем в равновесной (см. точку “б”). Если газовая смесь имеет состав в точке “в”, то восстановительный процесс не возможен, а наоборот, может иметь место окисление металла.
Если в газовой
фазе содержится только два газа, то
![]() .
.
В этом случае
 .
.
В данном случае
имеем уравнение с одним неизвестным,
из которого находим
![]() .
.
![]() в том случае, если
коэффициенты перед СО и СО2 равны.
в том случае, если
коэффициенты перед СО и СО2 равны.
2.Сродство металла к кислороду намного меньше сродства СО к кислороду.
Таким образом,
![]()
![]()
![]()
В этом случае сильно отрицательная величина, следовательно константа равновесия будет большой величиной.

![]()
![]()
Это значит, что в равновесном газе доля СО2 значительно превышает долю СО.
3.Сродство у металла к кислороду значительно выше, чем у СО.
Таким образом,
![]()
![]()
![]()
В этом случае величина будет величиной положительной, а константа равновесия будет очень маленькой величиной.
![]()
![]()
Это значит, что в равновесной газовой фазе доля СО составляет практически 100 %.
Данная схема анализа положена в основу классификации оксидов по восстановимости:
I группа – средневосстановимые оксиды – FeO, SnO, MoO, ZnO.
II группа – легковосстановимые оксиды – NiO, CuO, PbO, MgO.
III группа – трудновосстановимые оксиды – MnO, Al2O3, CaO,V2O3
Газы СО и Н2 имеют практически одинаковые восстановительные свойства, потому что сродство к кислороду у них почти одинаково. Анализ необходимых восстановительных смесей показывает, что газами СО и Н2 рационально восстанавливать средне- и легковосстановимые оксиды металлов, а трудновосстановимые оксиды рациональнее восстанавливать твердым углеродом или металлом – восстановителем.
11. Закономерности восстановительных процессов в системах с
растворами
В большинстве случаев чистые вещества при повышении температуры участвуют в реакциях только в определенных долях от суммарного процесса. В дальнейшем оксиды могут переходить в шлак (растворы), а металлы – растворяться друг в друге. Доля процессов с участием веществ в чистом виде и при наличии растворов зависит от:
-состава шихты
-скорости реакции восстановления
-скорости процессов шлакообразования
-температуры ведения процессов.
Влияние наличия растворов в системе на результат процесса оценивают, сравнивая между собой реакции между чистыми веществами и реакции с растворами.
Рассмотрим восстановительные процессы в системах с растворами. (В качестве восстановителя используем газ СО).
Реакция между чистыми веществами:
![]()
![]()
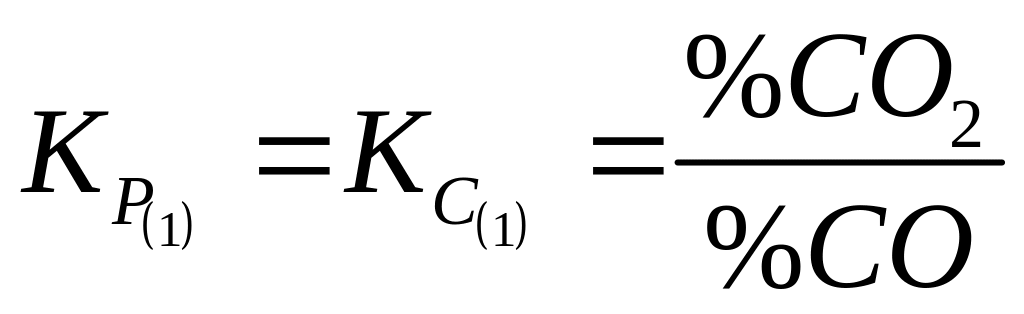
Оксид является чистой фазой, а металл способен растворяться в другом металле с образованием раствора.
![]()
![]()

Если вещества
одинаковы в реакциях, и если имеет место
одни и те же температуры, тогда
![]() ,
это означает, что
,
это означает, что
![]()
Сравнив эти два варианта получаем:
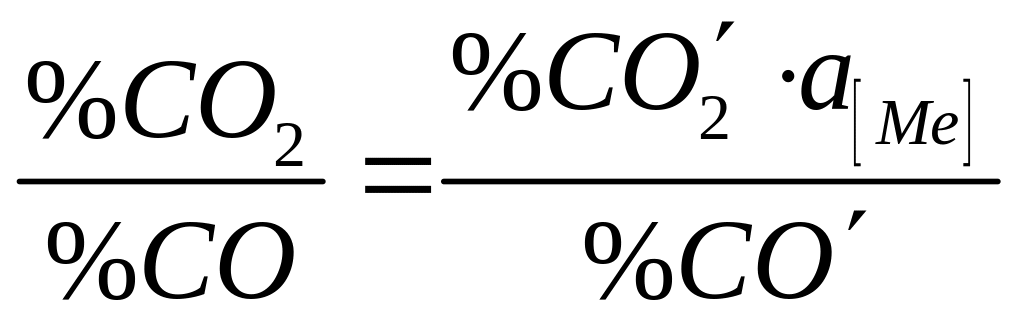
Следовательно:
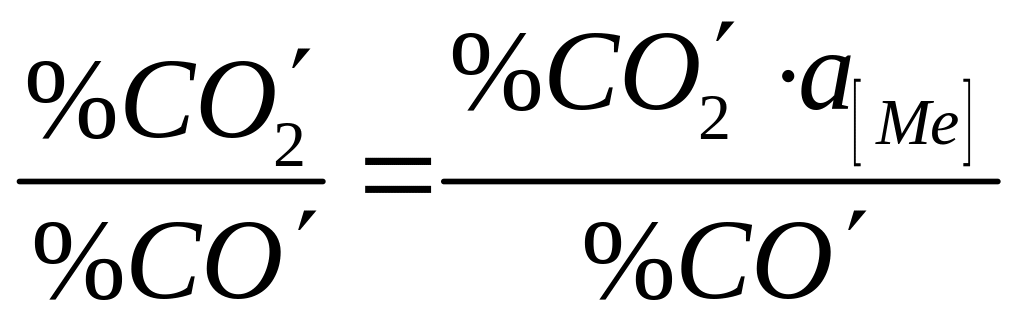
т.к.
величина
![]() ,
то
,
то

Это означает, что, когда металл переходит в раствор, то в равновесном газе будет содержаться больше СО2 по сравнению с реакцией между чистыми веществами.

Равновесные кривые для процессов восстановления, сопровождающихся переходом металла в раствор, всегда отвечают более высоким концентрациям СО2 (рисунок). Если металл способен растворяться в другом металле, то условия его восстановления из оксида облегчаются. Если сырье многокомпонентно, то чистый металл получить из него невозможно, всегда будет получаться либо сплав, либо металл, содержащий примеси.
Металл находится в чистом виде, оксид находится в шлаке.
![]()
![]()
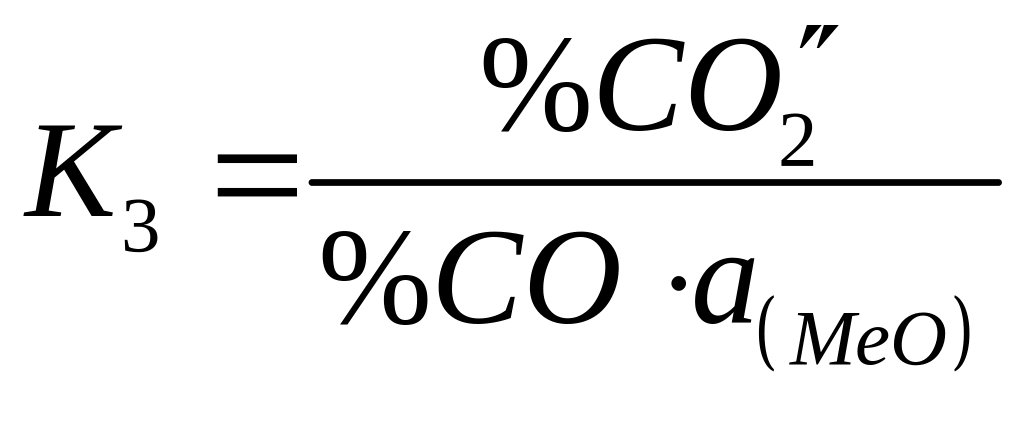
В данном случае
имеем, что
![]() ,
т.е.
,
т.е.

Т.к.
![]() ,
тогда получаем
,
тогда получаем
Следовательно
Это означает, что в равновесном газе в системе, где оксид находится в шлаке, доля СО будет больше, чем в реакции с чистыми веществами.
Чем меньше оксида остается в шлаке, тем выше должна быть доля СО в равновесном газе, тем выше должна быть концентрация СО в восстановительной смеси. Таким образом, если оксид находится в шлаке, то он восстанавливается труднее, и тем труднее, чем меньше его остается в шлаке. Теория говорит о том, что оксид из шлака полностью восстановить невозможно.
