
- •Оглавление
- •5.Закон Дальтона.
- •6 .Дослід Штерна. Визначення швидкостей молекул у досліді Штерна
- •13.Експериментальна перевірка закону косинуса потоку газових молекул на стінку.
- •14. Дослід Перрена. (за допомогою ф-ли Больцмана
- •15. З об'єднаного розподілу молекул за швидкостями Максвела-Больцмана отримати розподіл Максвела
- •16. З об'єднаного розподілу Максвелла-Больцмана отримати розподіл Больцмана.
- •17. З біноміального розподілу отримати розподіл Пуассона.
- •18.Дослід Перрена з броунівським рухом частинок по визначенню числа Авогадро
- •19. Обертальний броунівський рух
- •20. Молекулярні пучки. Зміна кількості молекул у пучку внаслідок зіткнень молекул газу.
- •2 1. Експериментальне визначення довжини вільного пробігу(досл. Борна – Бормана)
- •27. Якісна картина виникнення радіометричного ефекту. Залежність проявлення причини виникнення ефекту від тиску. Демонстрація радіометричного ефекту.
- •28. Основне рівняння вакуумної техніки
- •29 Режими течії. Число Рейнольдса.
- •31 Форвакуумні насоси (пластинково-роторні , пластинково-статорні , золотникові
- •32. Дифузійний пароструйний насос.
- •41.Тепловий манометр.
- •42.В’язкісний манометр.
- •43. Радіометричний манометр.
- •2.8 Еквівалентність формулювань постулатів другого начала термодинаміки за Клаузіусом і Томсоном і Планком
- •2.9 К.К.Д. Циклу Карно
- •2.10. Перша теорема Карно.
- •2.11.Друга теорема Карно.
- •2.18.Кількісне формулювання другого начала термодинаміки.
- •2.19. Закон зростання ентропії. Процеси теплопередачі та розширення ідеального газу у вакуум.
- •2.20.Закон зростання ентропії. Дифузія. Парадокс Гібсса.
- •2.22. Межі застосування другого начала термодинаміки.
- •2.23.Співвідношення між ентропією та імовірністю, формула Больцмана.
2.18.Кількісне формулювання другого начала термодинаміки.
Для
будь-якого оборотного не кругового
процесу кількість теплоти не залежить
від форми шляху:
![]()
2.19. Закон зростання ентропії. Процеси теплопередачі та розширення ідеального газу у вакуум.
δQ = 0
dS >= 0, S1 – S2 >= 0
В адіабатичній оболонці:
При необоротних процесах (розширення газу у вакуумі) ентропія зростає. При оборотних – не змінюється.
2.20.Закон зростання ентропії. Дифузія. Парадокс Гібсса.
П
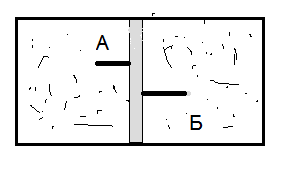
ΔSa = vaRln(V/Va)
ΔSb = vbRln(V/Vb)
Сумарна : ΔS = ΔSa + ΔSb = vaRln(V/Va) + + vbRln(V/Vb) = /*Va = Vb = V/2*/= (υa + υb)Rln2=/* Газ А прямує в газ Б, тому υa = υb = υ*/=2υRln2
А з іншого боку: ΔS = 0 ( макропараметри не змінюються Т,р,V = const ).
Виникає парадокс Гібсса: його розвязок полягає в тому, що властивості газів не можна наближати один до одного плавно.
2.22. Межі застосування другого начала термодинаміки.
У явимо
тут пристрій (“демона”), який пропускає
в праву частину тільки швидкі, а в ліву
— тільки повільні молекули. “Демон”
спростовує 2 начало, яке забороняє
самовільне виникнення різниці температур.
Насправді парадоксу немає: друге начало
термодинаміки застосовне тільки для
макроскопічних тіл із великою кількістю
частинок. Для “демона” газ не є
макроскопічним тілом, якщо він виділяє
окремі молекули.
явимо
тут пристрій (“демона”), який пропускає
в праву частину тільки швидкі, а в ліву
— тільки повільні молекули. “Демон”
спростовує 2 начало, яке забороняє
самовільне виникнення різниці температур.
Насправді парадоксу немає: друге начало
термодинаміки застосовне тільки для
макроскопічних тіл із великою кількістю
частинок. Для “демона” газ не є
макроскопічним тілом, якщо він виділяє
окремі молекули.
2.23.Співвідношення між ентропією та імовірністю, формула Больцмана.
![]()
 ,де
S-ентропія. S=S1+S2,
p=p1+p2,
-> f(p)=f(p1)+f(p2)->f(p1p2)=f(p1)+f(p2)
,де
S-ентропія. S=S1+S2,
p=p1+p2,
-> f(p)=f(p1)+f(p2)->f(p1p2)=f(p1)+f(p2)
V2,S2
V1,S1
S=αln(p)+const
αln(p1p2)+const=αln(p1)+const+αln(p2)+const
const=01
V1 V
V ![]() ,
,
![]()
V2
V1
V2


![]()
![]()
![]() ,
,
![]() ,
,![]() ,
,![]() ,
,
![]() ,
,
![]()
![]() -формула
Больцмана.
-формула
Больцмана.
