
- •Оглавление
- •5.Закон Дальтона.
- •6 .Дослід Штерна. Визначення швидкостей молекул у досліді Штерна
- •13.Експериментальна перевірка закону косинуса потоку газових молекул на стінку.
- •14. Дослід Перрена. (за допомогою ф-ли Больцмана
- •15. З об'єднаного розподілу молекул за швидкостями Максвела-Больцмана отримати розподіл Максвела
- •16. З об'єднаного розподілу Максвелла-Больцмана отримати розподіл Больцмана.
- •17. З біноміального розподілу отримати розподіл Пуассона.
- •18.Дослід Перрена з броунівським рухом частинок по визначенню числа Авогадро
- •19. Обертальний броунівський рух
- •20. Молекулярні пучки. Зміна кількості молекул у пучку внаслідок зіткнень молекул газу.
- •2 1. Експериментальне визначення довжини вільного пробігу(досл. Борна – Бормана)
- •27. Якісна картина виникнення радіометричного ефекту. Залежність проявлення причини виникнення ефекту від тиску. Демонстрація радіометричного ефекту.
- •28. Основне рівняння вакуумної техніки
- •29 Режими течії. Число Рейнольдса.
- •31 Форвакуумні насоси (пластинково-роторні , пластинково-статорні , золотникові
- •32. Дифузійний пароструйний насос.
- •41.Тепловий манометр.
- •42.В’язкісний манометр.
- •43. Радіометричний манометр.
- •2.8 Еквівалентність формулювань постулатів другого начала термодинаміки за Клаузіусом і Томсоном і Планком
- •2.9 К.К.Д. Циклу Карно
- •2.10. Перша теорема Карно.
- •2.11.Друга теорема Карно.
- •2.18.Кількісне формулювання другого начала термодинаміки.
- •2.19. Закон зростання ентропії. Процеси теплопередачі та розширення ідеального газу у вакуум.
- •2.20.Закон зростання ентропії. Дифузія. Парадокс Гібсса.
- •2.22. Межі застосування другого начала термодинаміки.
- •2.23.Співвідношення між ентропією та імовірністю, формула Больцмана.
2.9 К.К.Д. Циклу Карно
К.к.д.
теплової машини за означенням: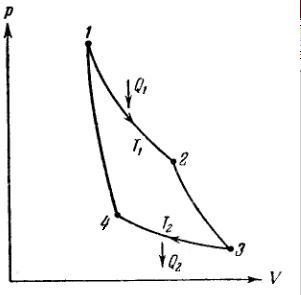
 ,
де
,
де ![]() тепло,
отримане від нагрівача,
віддане
холодильнику.
тепло,
отримане від нагрівача,
віддане
холодильнику.
За першим началом термодинаміки:

 .
.
Оскільки 2→3 і 4→1 є адіабатами, то виконуються наступні рівності:


![]() ;
;
![]() .
.
 ( умова замкнутості циклу).
( умова замкнутості циклу).
Підставимо все у початковий вираз:

Враховуючи умову замкненості, отримаємо:

2.10. Перша теорема Карно.
П

А12 + А23 - А34 - А41 = А
N = A/Q = (Q1 - Q2 ) / Q1
К

1 - взяла Q1, виконала А, віддала Q2 .
2 - взяла Q1’, за рахунок виконання A’, віддала Q2’.
N = (Q1- Q2 ) / Q1
N’ = (Q1’ - Q2’)/ Q1’.
Доведемо, що N = N’.
Припустимо, що N’ > N. Підберемо цикл так щоб Q1 = Q1’. Одже отримаємо:
А - NQ1 > A’ - N Q1’.
A – A’ = (N - N’) Q > 0
Корисна робота виконана без використання холодильника -> невірно! Отже, N = N'
Припустимо, що N’ > N . Запускаємо машини в зворотньому напрямку, отримуємо суперечність, отже N = N’.
Звідси N = N!
2.11.Друга теорема Карно.
К КД
теплової машини, що працює за необоротним
циклом Карно не може перевищувати ККД
машини, що працює за оборотним циклом
К., між тими ж холодильником і нагрівачем.
КД
теплової машини, що працює за необоротним
циклом Карно не може перевищувати ККД
машини, що працює за оборотним циклом
К., між тими ж холодильником і нагрівачем.
N =A/Q = (Q1 - Q2 ) / Q1 = (Т1 - Т2) / Т1
Q1 = A1 = p1 (V2 - V1)
бA = pdV
p = RT/V
бА = RT1 (dV/V)
![]()
![]()
Cv dT + бA = 0
A23 = Cv(T2 - T1) = - Cv (T1 - T2) = -A41

TVɤ-1 = const, PVɤ = const
(V2/V1) = (V3/V4)
2.12. Третя теорема Карно.

ККД будь-якої машини (реальної) не може перевищувати ККД машини, що працює за оборотним циклом Карно, і цей цикл відбувається між найбільшою температурою нагрівача і найменшою температурою холодильника.
N = A / Q1.
2.13. Методом циклів знайти залежність внутрішньої енергії ідеального газу від об`єму.
М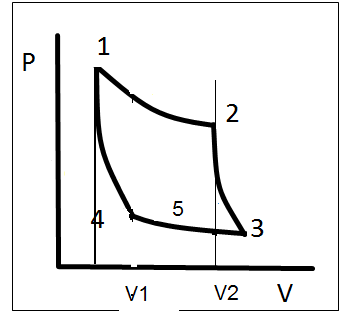 етод
циклів.
етод
циклів.
f =(p, V, T) = 0
U (V, T) = 0
![]()
N = A / Q1 = T1 – T2 / T1, при малих р;
А = (V2 – V1)(δp / δT) (T2 – T1)
Q1 = U2 – U1 – pΔV = (V2 – V1) + p(V2V1)

![]() = T
= T![]() - p.
- p.
2.15. Нерівність Клаузіуса.
Якщо
круговий процес не оборотний, то з нього
випливає нерівність Клаузіуса
![]() .
Внаслідок повернення в початкову точку
через необоротний процес
.
Внаслідок повернення в початкову точку
через необоротний процес
Ентропія зростає!
2.16. Поняття про ентропію
Н езалежність
суми
езалежність
суми ![]() від шляху, по якому проходить оборотний
перехід, дає можливість стверджувати,
що при оборотному процесі
від шляху, по якому проходить оборотний
перехід, дає можливість стверджувати,
що при оборотному процесі ![]() являє собою приріст деякої функції
стану, яку назвемо ентропією(позначають
S).
являє собою приріст деякої функції
стану, яку назвемо ентропією(позначають
S).
Для довільного процесу:
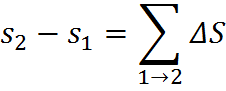
Для оборотного процесу приріст ентропії - відношення елементарної кількості теплоти, що отримує система, до температури, при якій це тепло отримане:

Ентропія ізольованої системи може збільшуватися(при протіканні необоротного процесу) або залишатися сталою(при протіканні оборотного процесу). Зменшуватися ентропія ізольованої системи не може. Для одного моля(якщо вважати теплоємність сталою):
![]()
2.17.Ентропійна діаграма. Її еквівалентність циклу Карно.

Цикл Карно. Ентропійна діаграма.
N = (Q1 – Q2 ) / Q1 = [T1(S1 – S2) – T2(S1 – S2)] / T1(S1 – S2) = (T1 – T2) / T1 =
= 1 – T2/T1.
=>Q1 = T1 (S1 – S2), Q2 = T2 (S1 – S2)
