
- •Оглавление
- •5.Закон Дальтона.
- •6 .Дослід Штерна. Визначення швидкостей молекул у досліді Штерна
- •13.Експериментальна перевірка закону косинуса потоку газових молекул на стінку.
- •14. Дослід Перрена. (за допомогою ф-ли Больцмана
- •15. З об'єднаного розподілу молекул за швидкостями Максвела-Больцмана отримати розподіл Максвела
- •16. З об'єднаного розподілу Максвелла-Больцмана отримати розподіл Больцмана.
- •17. З біноміального розподілу отримати розподіл Пуассона.
- •18.Дослід Перрена з броунівським рухом частинок по визначенню числа Авогадро
- •19. Обертальний броунівський рух
- •20. Молекулярні пучки. Зміна кількості молекул у пучку внаслідок зіткнень молекул газу.
- •2 1. Експериментальне визначення довжини вільного пробігу(досл. Борна – Бормана)
- •27. Якісна картина виникнення радіометричного ефекту. Залежність проявлення причини виникнення ефекту від тиску. Демонстрація радіометричного ефекту.
- •28. Основне рівняння вакуумної техніки
- •29 Режими течії. Число Рейнольдса.
- •31 Форвакуумні насоси (пластинково-роторні , пластинково-статорні , золотникові
- •32. Дифузійний пароструйний насос.
- •41.Тепловий манометр.
- •42.В’язкісний манометр.
- •43. Радіометричний манометр.
- •2.8 Еквівалентність формулювань постулатів другого начала термодинаміки за Клаузіусом і Томсоном і Планком
- •2.9 К.К.Д. Циклу Карно
- •2.10. Перша теорема Карно.
- •2.11.Друга теорема Карно.
- •2.18.Кількісне формулювання другого начала термодинаміки.
- •2.19. Закон зростання ентропії. Процеси теплопередачі та розширення ідеального газу у вакуум.
- •2.20.Закон зростання ентропії. Дифузія. Парадокс Гібсса.
- •2.22. Межі застосування другого начала термодинаміки.
- •2.23.Співвідношення між ентропією та імовірністю, формула Больцмана.
Оглавление
1. Ергодична гіпотеза 5
2. Закон Бойля-Маріотта. Ізотермічний коефіцієнт стисливості, його залежність від тиску. 5
3. Закон Гей-Люссака. Коефіцієнт об’ємного розширення, його фізичний зміст, залежність від тиску, природи газу. Закон Гей-Люссака у традиційній формі. 6
4. Закон Шарля Температурний коефіцієнт тиску, його фізичний зміст, залежність від тиску, природи газу. 6
5.Закон Дальтона. 7
6.Дослід Штерна. Визначення швидкостей молекул у досліді Штерна 8
7. За розподілом Максвелла визначити найбільш імовірну швидкість молекули 9
8. За розподілом Максвелла визначити середню арифметичну швидкість молекули 9
9. За розподілом Максвелла визначити середню арифметичну швидкість молекули 9
10.Формула Максвелла для відносних швидкостей 9
11.Розподіл молекул за значенням кінетичної енергії 9
1.12 Дослід Штерна-Істермана-Сімсона по перевірці закону розподілу молекул за швидкостями Максвела 9
13.Експериментальна перевірка закону косинуса потоку газових молекул на стінку. 10
14. Дослід Перрена. (за допомогою ф-ли Больцмана 10
15. З об'єднаного розподілу молекул за швидкостями Максвела-Больцмана отримати розподіл Максвела 11
16. З об'єднаного розподілу Максвелла-Больцмана отримати розподіл Больцмана. 12
17. З біноміального розподілу отримати розподіл Пуассона. 12
18.Дослід Перрена з броунівським рухом частинок по визначенню числа Авогадро 13
19. Обертальний броунівський рух 13
20. Молекулярні пучки. Зміна кількості молекул у пучку внаслідок зіткнень молекул газу. 14
21. Експериментальне визначення довжини вільного пробігу(досл. Борна – Бормана) 14
22. В'язкість газів 15
23. дослід Шлейєрмахера 16
24 Самодифузія . Коефіцієнт самодифузії , його залежність від тиску і температури 17
25.Термічна ефузія. Демонстрація Поля явища термічної ефузії. 17
26. Ізотермічна ефузія. Демонстрація явища ізотермічної ефузії 18
27. Якісна картина виникнення радіометричного ефекту. Залежність проявлення причини виникнення ефекту від тиску. Демонстрація радіометричного ефекту. 19
28. Основне рівняння вакуумної техніки 20
29 Режими течії. Число Рейнольдса. 20
31 Форвакуумні насоси (пластинково-роторні , пластинково-статорні , золотникові 21
32. Дифузійний пароструйний насос. 23
33. Багатоступінчасті дифузійні насоси. 24
34. Кріогенні насоси 25
35. Адсорбційний вакуумний насос. 25
36. Орбітронний насос 27
37. Магніторозрядний насос 28
38. Молекулярний насос 28
39. Турбомолекулярний насос. 29
40. Абсолютні манометри(U – подібний і Мак-Леода).Довести що вони є абсолютними 29
41.Тепловий манометр. 30
42.В’язкісний манометр. 31
43. Радіометричний манометр. 31
44. Іонізаційний манометр 31
2.1. Кількісне формулювання першого начала термодинаміки. 32
2.2. Рівняння Роберта Майєра 32
3.Робота при адіабатному процесі 32
2.4. Робота при політропному процесі 32
2.5. Із виразу для роботи при політропному процесі отримати вирази для роботи всіх ізопроцесів. 32
2.6 Внутрішня енергія і теплоємність одно-, двох-, багатоатомного газу 33
2.7 Принцип дії теплової та холодильної машини . Коефіцієнт корисної дії 33
2.8 Еквівалентність формулювань постулатів другого начала термодинаміки за Клаузіусом і Томсоном і Планком 34
2.9 К.к.д. циклу Карно 35
2.10. Перша теорема Карно. 36
2.11.Друга теорема Карно. 38
2.12. Третя теорема Карно. 39
2.13. Методом циклів знайти залежність внутрішньої енергії ідеального газу від об`єму. 39
2.15. Нерівність Клаузіуса. 39
2.16. Поняття про ентропію 40
2.18.Кількісне формулювання другого начала термодинаміки. 42
2.19. Закон зростання ентропії. Процеси теплопередачі та розширення ідеального газу у вакуум. 42
2.20.Закон зростання ентропії. Дифузія. Парадокс Гібсса. 43
2.22. Межі застосування другого начала термодинаміки. 43
2.23.Співвідношення між ентропією та імовірністю, формула Больцмана. 44
1. Ергодична гіпотеза
Позначимо
кількість стат. систем через
![]() , а через
, а через
![]() -кількість
комірок в системі , тоді :
-кількість
комірок в системі , тоді :
Середнє
за ансамблем :![]()
Середнє
за часом :![]()
Власне ергодична гіпотеза полягає в тому , що середнє за ансамблем рівне середньому за часом .
2. Закон Бойля-Маріотта. Ізотермічний коефіцієнт стисливості, його залежність від тиску.
PV=const T=const
![]()
 -
ізотермічний коефіцієнт стисливості
-
ізотермічний коефіцієнт стисливості
![]() ;
dV- зміна об’єму газу, що
викликає зміну тиску dP
;
dV- зміна об’єму газу, що
викликає зміну тиску dP
V- початковий об’єм
![]()
![]() :dP
:dP
![]() ;
;
![]()
![]() ;
Мінус, вказує на те що збільшення об’єму
призводить до зменшення тиску. Із ростом
тиску
знижується - у газу
стає менше можливостей ще більше
стискатися.
;
Мінус, вказує на те що збільшення об’єму
призводить до зменшення тиску. Із ростом
тиску
знижується - у газу
стає менше можливостей ще більше
стискатися.
3. Закон Гей-Люссака. Коефіцієнт об’ємного розширення, його фізичний зміст, залежність від тиску, природи газу. Закон Гей-Люссака у традиційній формі.
P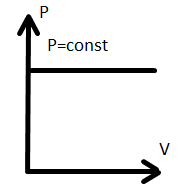 =const
=const
![]() ;
;
![]() -
коефіцієнт об’ємного розширення газу.
-
коефіцієнт об’ємного розширення газу.
![]()

![]()
![]()
![]() ;
Тобто коефіцієнт об’ємного розширення
ідеального газу обернено пропорційний
абсолютній температурі. Коефіцієнт
теплового розширення називається
відношення приросту об’єму тіла при
нагріванні на 1 градус Цельсія при умові,
що P=const.
;
Тобто коефіцієнт об’ємного розширення
ідеального газу обернено пропорційний
абсолютній температурі. Коефіцієнт
теплового розширення називається
відношення приросту об’єму тіла при
нагріванні на 1 градус Цельсія при умові,
що P=const.
4. Закон Шарля Температурний коефіцієнт тиску, його фізичний зміст, залежність від тиску, природи газу.
Т![]() иск
деякої маси газу при нагріванні на
1° в незмінному
об’ємі збільшується
иск
деякої маси газу при нагріванні на
1° в незмінному
об’ємі збільшується
![]() частину
тиску при
0°С .(закон Шарля). Величина a,
показує, на яку частину тиску при 0°С
збільшується тиск газу при нагріванні
на 1°, має одне і те ж значення для всіх
газів, а саме
частину
тиску при
0°С .(закон Шарля). Величина a,
показує, на яку частину тиску при 0°С
збільшується тиск газу при нагріванні
на 1°, має одне і те ж значення для всіх
газів, а саме
![]() .
Приріст температури t -> приріст тиску
a
.
Приріст температури t -> приріст тиску
a![]() t,
шуканий тиск: Р =Р0+aР0t=
Р0(1+at)=
Р0(1+
t,
шуканий тиск: Р =Р0+aР0t=
Р0(1+at)=
Р0(1+![]() )
Величину a називають
термічним, коефіцієнтом тиску.
)
Величину a називають
термічним, коефіцієнтом тиску.
