
- •Хімічна кінетика і каталіз хі. Хімічна кінетика хі. І. Основні поняття хімічної кінетики
- •Хі.2. Швидкість хімічних реакцій
- •Хі.3. Кінетична класифікація реакцій. Молекулярність і порядок реакцій
- •Хі.4. Необоротні реакції першого порядку
- •4Nо2 2n2о4 (швидка)
- •Хі.5. Необоротні реакції другого, третього та n-го порядків
- •Хі.6. Визначення порядку і константи швидкості реакції
- •Хі.7.Складні реакції
- •Хі.8. Реакції в газовому потоці
- •Хі.9. Вплив температури на швидкість реакції
- •Можна передбачити, що взагалі
- •Таким чином
- •Хі.10. Тепловий вибух
- •Хі.11. Теорія активних зіткнень
- •Наприклад, це може бути розклад гідроген йодиду
- •Хі.12. Теорія активного комплексу або перехідного стану
- •Хі.13. Мономолекулярні реакції
- •Хі.14. Тримолекулярні реакції
- •Хі. 15. Реакції в розчинах
- •Хі.16. Ланцюгові і фотохімічні реакції
- •Хі.17. Гетерогенні процеси
Хі.8. Реакції в газовому потоці
У виробничих умовах доцільно проводити хімічні процеси не в замкнутих реакторах, що містять певну кількість реагентів, а в потоці, коли вихідні речовини безперервно поступають у реактор, а продукти реакцій виводяться з нього. Зазвичай, реактор має форму труби, в один кінець якої вводяться вихідні реагенти, а з іншого виводяться продукти реакції.
Нехай у циліндричний реактор об’ємом
V = S·l, де S площа
поперечного перерізу, l
довжина реактора, в який поступає
газопарова суміш вихідної речовини зі
швидкістю υ (м3/с). Лінійна
швидкість потоку в реакторі
![]() (м/с)
рівна відношенню швидкості подачі (υ)
до перетину реактора (s). Виходячи з
вищесказаного, вводять поняття об’ємної
швидкості. Об’ємною швидкістю
(м/с)
рівна відношенню швидкості подачі (υ)
до перетину реактора (s). Виходячи з
вищесказаного, вводять поняття об’ємної
швидкості. Об’ємною швидкістю
![]() (с
1)
називають об’єм газопарової реакційної
суміші (при Т і р у реакційній зоні), що
проходить в одиницю часу в одиницю
об’єму реактора. Величина, обернена до
об’ємної швидкості 1/η = τ є часом
проходження газу через реактор. Цей час
називається часом контактування і
відіграє роль фізичного часу протікання
реакції. Вимірюючи ступінь перетворення
х(%) в залежності від часу контактування
τ, можна побудувати кінетичну криву,
тобто залежність х = f(τ).
(с
1)
називають об’єм газопарової реакційної
суміші (при Т і р у реакційній зоні), що
проходить в одиницю часу в одиницю
об’єму реактора. Величина, обернена до
об’ємної швидкості 1/η = τ є часом
проходження газу через реактор. Цей час
називається часом контактування і
відіграє роль фізичного часу протікання
реакції. Вимірюючи ступінь перетворення
х(%) в залежності від часу контактування
τ, можна побудувати кінетичну криву,
тобто залежність х = f(τ).
Кінетика реакції в потоці, в принципі, підкоряється тим же законам, що і в стаціонарних умовах (в замкнутому об’ємі), але час реакції замінюється на час контактування.
Окрім цього, вводиться поправка на зміну
об’єму газової суміші при зміні числа
молей у ході реакції, так як в статичних
умовах
![]() ,
а в потоці
,
а в потоці
![]() .
.
Хі.9. Вплив температури на швидкість реакції
Швидкість хімічної реакції залежить не лише від концентрації речовин, але і від температури. Для більшості реакцій підвищення температури веде до зростання швидкості. Лише для невеликого числа реакцій збільшення швидкості із зростанням температури незначне або, навпаки, реакція протікає з уповільненням. Орієнтовно вплив температури на константу швидкості оцінюється величиною температурного коефіцієнта швидкості реакції γ, який показує, в скільки разів збільшується швидкість реакції при підвищенні температури на 10º:
![]() (ХІ.9.1)
(ХІ.9.1)
або
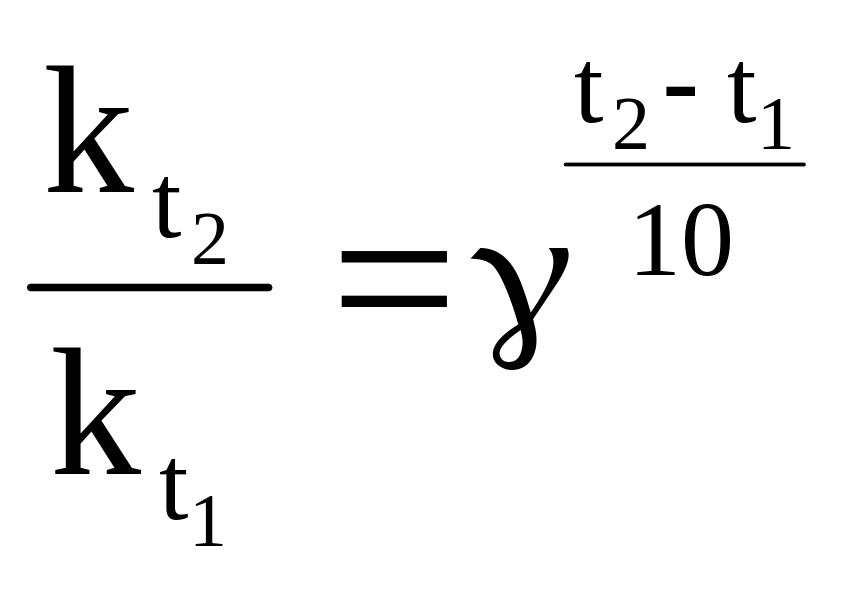 , (ХІ.9.2)
, (ХІ.9.2)
де kt
і kt+10 константи
швидкості при температурах t і t + 10º, а
![]() і
і
![]() константи швидкості
при температурах t1 і t2,
відповідно. Для багатьох гомогенних
реакцій при підвищенні температури на
10º швидкість збільшується у 2-4 рази,
тобто γ = 2-4 (правило Вант-Гоффа).
константи швидкості
при температурах t1 і t2,
відповідно. Для багатьох гомогенних
реакцій при підвищенні температури на
10º швидкість збільшується у 2-4 рази,
тобто γ = 2-4 (правило Вант-Гоффа).
Щоб дві молекули вступили в реакцію одна з одною, вони, мабуть, повинні зіткнутися. Проте підрахунок числа зіткнень показує, що далеко не кожне зіткнення веде до реакції. Так, в 1 моль НІ, що знаходиться в об’ємі 1 л, при 101,3 кПа і 556 К відбувається в 1 с 5,5·1034 зіткнень. Кількість йоду, що утворюється за той же проміжок часу, показує, що з цього числа лише 3,0·1017 зіткнень були ефективними, тобто привели до реакції:
НІ + НІ = Н2 + І2
Арреніус висловив думку, що реакційноздатними є не всі, а лише активні молекули. Це означає, що для того, щоб при зіткненні відбулась хімічна реакція, необхідно, щоб молекули в момент зіткнення володіли деяким надлишком енергії над середньою енергією. Надлишкова енергія називається енергією активації. Саме дякуючи цій обставині, багато реакцій, які цілком можливі, затримуються або практично зовсім не протікають. Наприклад, дерево, папір, гас, різні тканини здатні окиснюватися і горіти у повітрі. Причина того, що вони не загораються “самі по собі” в звичайних умовах, полягає в значній енергії активації відповідних окисних реакцій. Підвищення температури веде до того, що все частіше і частіше в момент зіткнення молекули кисню і горючого матеріалу виявляються достатньо “гарячими”, тобто такими, що мають необхідний надлишок енергії, і на кінець швидкість реакції досягає значної величини починається процес горіння.
Арреніус виразив залежність константи швидкості від температури рівнянням:
![]() ,
(ХІ.9.3)
,
(ХІ.9.3)
де А і В константи характерні для даної реакції.
З іншого боку, константа рівноваги, рівна відношенню констант швидкості прямої і зворотної реакцій, залежить від температури таким чином (рівняння ізобари):
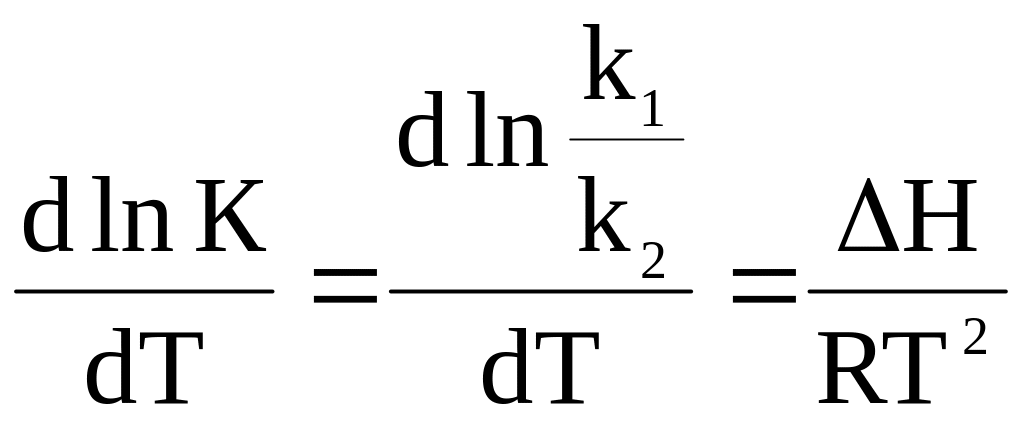 . (ХІ.9.4)
. (ХІ.9.4)
Це рівняння запишемо в такому вигляді
![]() (ХІ.9.5)
(ХІ.9.5)
Але ΔН (теплота реакції) при р = const, можна зобразити як різницю енергій активації прямої і зворотної реакцій. Розглянемо діаграму, що подана на рис. 60. Зрозуміло, що
![]() і
і
![]() (ХІ.9.6)
(ХІ.9.6)
