
Содержание
1. Структура воды…………………………………………………..2
2. Влияние ионов на структуру воды…………………………….7
3.Влияние неполярных молекул на структуру воды…………..9
4.Гидрофобные взаимодействия и макромолекулы………….11
5.Взаимодействие макромолекул с водой………………………14
6.Денатурация макромолекул и вода……………………………17
7.Вода в биологических системах. ………………………………19
8. Список литературы………………………………………….....22
1. Структура воды
Аномальные свойства воды обусловлены особенностью структуры ее молекулы. Впервые эта идея была развита в классической работе Бернала и Фаулера [1, 2] более тридцати лет тому назад и послужила основой для всех дальнейших теорий структуре воды [З].
В молекуле H2O три ядра образуют равнобедренный треугольник с двумя протонами в основании и углом НОН, близким к тетраэдрическому [1-4].
Из десяти электронов молекулы воды два электрона находятся вблизи ядра кислорода, остальные же восемь движутся попарно по четырем вытянутым эллиптическим орбитам. Оси двух орбит направлены на вдоль связей 0-Н, оси двух других лежат в плоскости, перпендикулярной НОН, причем угол между ними также близок к тетраэдрическому [5-7]. Таким образом, оси четырех эллиптических орбит направлены к вершинам тетраэдра.
Э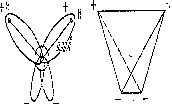 лектроны,
движущиеся по орбитам в плоскости,
перпендикулярной к плоскости НОН,
образуют так называемые уединенные
пары электронов, которые играют очень
существенную роль
во взаимодействии
молекул воды [8, 9].
Эти электроны
обуславливают сравнительно большое
значение электронной плотности в
периферической части молекулы воды,
противоположной той в, которой расположены
атом водорода (рис. 1).
лектроны,
движущиеся по орбитам в плоскости,
перпендикулярной к плоскости НОН,
образуют так называемые уединенные
пары электронов, которые играют очень
существенную роль
во взаимодействии
молекул воды [8, 9].
Эти электроны
обуславливают сравнительно большое
значение электронной плотности в
периферической части молекулы воды,
противоположной той в, которой расположены
атом водорода (рис. 1).
Согласно
Бьерруму [10], можно принять, что
электрические заряды молекулы
сосредоточены в вершинах тетраэдра
(два отрицательных и два п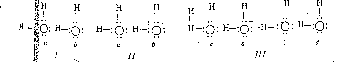 оложительных
величиной ± 0, 171е) на расстоянии 0, 99А от
ядра кислорода.
оложительных
величиной ± 0, 171е) на расстоянии 0, 99А от
ядра кислорода.
Во льду молекулы воды расположены таким образом, что они соприкасаются разноименными полюсами.
Однако, взаимодействие между молекулами воды не ограничивается кулоновым притяжением: электроны уединенной пары, соприкасаясь с протоном соседней молекулы, частично переходят на его s-орбиту, оттесняя при этом его собственное электронное облако, и, тем самым, усиливают отрицательный заряд молекулы с противоположной стороны. Таким образом, при контакте молекул воды происходит частичная делокализация или обобществление электрона, и, кроме того, разделение заряда. Такую связь между донором и акцептором электрона, которую обычно называют «водородной связью», фактически можно представить в виде суперпозиции следующих трех предельных структур [11-14]:
Здесь резонанс между структурами и II (с соответствующими весовыми факторами) представляет обычную частичную полярность 0-Н в молекуле b. Структура же III определяет частично ковалентный характер взаимодействия между молекулами а и b, но она приводит к частичному разделению зарядов, пропорционально своему весовому фактору. Тем самым молекула а, выражаясь химическим языком, делается более «кислой», молекула же b - более «щелочной». В результате облегчается их взаимодействие с соседними молекулами c и d. Более того, если имеется связь между молекулами с-а и b-d, то связь между молекулами а-b делается более прочной. Образование же цепочки c-a-b-d будет способствовать образованию Н-связей в тетраэдрическом направлении.
Кооперативный характер образования Н-связей между соседними молекулами, на который впервые обратили внимание Франк и Вэн [15, 16], играет исключительно важную роль в определении свойств воды и льда. Во льду каждая молекула воды связана со всеми своими четырьмя соседями, образуя максимально возможное число Н-связей. Сплошная сетка Н-связей объединяет все молекулы воды в единую систему, можно сказать, «одну гигантскую молекулу» [9], с исключительно ажурной структурой (рис. 2).
П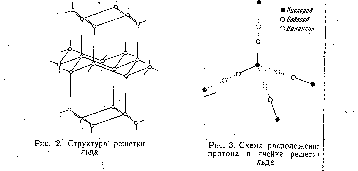 ривлекает
внимание тот факт, что протоны в этой
сетке находятся не посередине между
атомами кислорода, а располагаются
ближе к тому кислороду, с которым связаны
ковалентной связью [4] (рис. 3). Однако так
как строение молекул воды симметрично,
фактически у протонов имеется не одно,
а два равноправных положения и переходы
протона из одного положения в другое
могут рассматриваться, как переориентация
молекул и образование ионных пар.
ривлекает
внимание тот факт, что протоны в этой
сетке находятся не посередине между
атомами кислорода, а располагаются
ближе к тому кислороду, с которым связаны
ковалентной связью [4] (рис. 3). Однако так
как строение молекул воды симметрично,
фактически у протонов имеется не одно,
а два равноправных положения и переходы
протона из одного положения в другое
могут рассматриваться, как переориентация
молекул и образование ионных пар.
Переходы протонов между двумя возможными состояниями происходят по туннелю» водородной связи, который облегчает переход, по крайней мере, в 70 раз [17, 18]. Судя по данным нейтронографии [19], оба положения протона равновероятны, но конечно, переходы отдельных протонов не могут происходить полностью независимо так как это связано с перераспределением зарядов.
С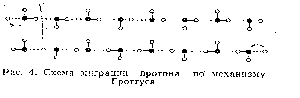 пособность
протона находиться в двух возможных
положениях в структуре льда объясняет
аномально высокую подвижность протона
во льду [20], приближающуюся к подвижности
электронов в металлах и некоторых
полупроводниках [16]
пособность
протона находиться в двух возможных
положениях в структуре льда объясняет
аномально высокую подвижность протона
во льду [20], приближающуюся к подвижности
электронов в металлах и некоторых
полупроводниках [16]
Согласно механизму Гротгуса, перемещается не один и тот же индивидуальный протон, а лишь форма его свободного состояния, т.е. протоны, присоединяются к ближайшей молекуле воды в цепи упорядоченной последовательности, от этой молекулы отщепляется другой протон и присоединяется к последующей и т.д. Таким
образом, возникает миграция протона сквозь туннели Н-связей, снижающие энергетические барьеры [18] (рис.4),
С
Таблица 1
Концентрация молекул воды с различным количеством Н-связей при различных температурах [21]
ледовательно, мы приходим к заключению, что структура упорядоченных молекул воды - лед обладает способностью дальнодействия.
Д ействительно,
любое нарушение в распределении протона
в начале цепи должно привести к
переориентации цепочки, и если это
нарушение заключается в присоединении
к началу цепи свободного протона, то в
результате переориентации, свободный
протон выделится на некотором расстоянии
от места присоединения, при этом
«протонный пробой» будет сопровождаться
волной разупорядочения структуры [20].
И, наоборот, если в разупорядоченной
системе молекул воды произойдет
какая-либо фиксация протонов в каком-либо
положении (например, возле какой-либо
поверхности), то такое упорядочение
должно распространяться на некоторое
расстояние и привести к упорядочению
протонов в определенном слое воды
ействительно,
любое нарушение в распределении протона
в начале цепи должно привести к
переориентации цепочки, и если это
нарушение заключается в присоединении
к началу цепи свободного протона, то в
результате переориентации, свободный
протон выделится на некотором расстоянии
от места присоединения, при этом
«протонный пробой» будет сопровождаться
волной разупорядочения структуры [20].
И, наоборот, если в разупорядоченной
системе молекул воды произойдет
какая-либо фиксация протонов в каком-либо
положении (например, возле какой-либо
поверхности), то такое упорядочение
должно распространяться на некоторое
расстояние и привести к упорядочению
протонов в определенном слое воды
Основное отличие структуры жидкой воды ото льда заключается в разрыве части связей под действием усиленных тепловых колебаний решетки и, как результат этого, в более размытом расположении атомов, образовании дефектов, увеличении среднего координационного числа, возникновении областей с плотной упаковкой.
Если во льду на один моль молекул воды приходится два моля Н-связей, то, по данным инфракрасной спектроскопии [21], при плавлении льда разрывается 46% связей. Причем, число молекул С2 с двумя связями составляет всего лишь 33% от количества всех молекул, молекул с одной связью C1 - 41%, молекул вообще без связи - Со - 27% (в этом случае подразумеваются лишь связи протонов данной молекулы с соседними молекулами).
С ростом температуры число разрывов повышается, что видно из приведенной таблицы, где Сн - относительное число неразорванных связей.
Рассматривая разрывы связей как химические реакции, по зависимости от константы равновесия (In k) от температуры (1/Т) можно рассчитать соответствующие теплоты реакции, или энтальпии разрыва связей. Таким образом, найдено, что
е1н = 1, 1 ккал/моль (S1 SO),
E2Н = 6 ккал/моль (S2)
E3Н =2, 7 ккал/моль (S2)
Экспериментально установленное различие между Е1H и Е1H подтверждает теоретически предсказанный Франком и Вэном [15, 16] кооперативный характер образования Н-связи,
Учитывая относительную концентрацию одинарных и двойных связей в воде можно рассчитывать из значений Е1H и Е2H среднюю величину энергии разрыва одного моля связей. Расчет дает, что ЕH = 1450 кал/моль
Обращает на себя внимание сравнительно низкое значение энергии разрыва Н-связей в воде. Обычно с энергией Н-связи ассоциируется величина порядка 4ккал/моль.
Обусловлено это тем, что найденные значения величин ЕH представляют не энергию разрыва Н-связи, а суммарное изменение энергии при изменении водородных и вандерваальсовых взаимодействий [21, 22]. Разрыв Н-связей приводит к заполнению пустот ажурной структуры льда молекулами воды. Упаковка молекул делается более плотной, иначе говоря, возрастает координационное число z. Однако сростом координационного числа, т.е. с повышением числа трудящихся бок о бок соседей возрастают вандерваальсовы взаимодействия каждой молекулы.
Кооперативный механизм образования Н-связей между молекулами воды крайне существенен, так как именно он определяет исключительно важное свойство воды, отличающее ее от остальных жидкостей, - ассоциативный характер ее строения.
Как уже говорилось, в воде при комнатной температуре более половины связей разорвано. Однако равномерное распределение разорванных связей по молекулам не является выгодным из-за кооперативного характера их образования. Оставшиеся связи как бы стараются сбиться в кучу, образуя в микрообластях ассоциаты с максимальным числом связей на молекулу, а следовательно, со структурой, близкой к структуре льда, обеспечивающей такое максимальное количество связей. Конечно, такие ассоциаты неустойчивы. Локальные флуктуации энергии приводят к их распаду и возникновению новых упорядоченных ассоциатов - кластеров. Время жизни кластеров - порядка 10-10 сек, т.е. порядка 1000 молекулярных колебаний.
Модель «мерцающих кластеров», рассмотренная впервые Франком и Вэном [15, 16], в дальнейшем развита Немети и Шерага [22] и в настоящее время является, по-видимому, наиболее разработанной моделью воды, хотя, возможно, и не лишенной недостатков.
Необходимо упомянуть о модели воды, предложенной Ленгар - Джонсом с Поплом [8, 9], согласно которой при плавлении льда происходит не разрыв, а лишь деформация Н-связей. Однако эта модель подразумевает слишком уже большую жесткость и упругость воды, которых она в действительности не проявляет.
Заслуживает внимания также модель Франка и Квиста [23], которые исходя из предположения, что часть молекул воды составляет каркас структуры, а часть заполняет полости каркаса. Причем, в связи с высокой симметрией поля в плоскостях каркаса, молекулы, попавшие в них, слабо взаимодействуют направленными связями с молекулами каркаса.
Несколько иной точки зрения придерживается Самойлов [3], согласно которому вода представляет дефектную структуру льда с размытым дальним порядком.
Согласно Немети и Шерага, молекулы в воде составляют пять классов, различающихся энергией и внутренней свободой. Молекулы воды, связанные с соседями четырьмя Н-связями, относятся к классу с нулевым энергетическим уровнем. Энергетический уровень молекул, у которых разорваны все связи, будет соответствовать энергии 4Еh. Между этими уровнями распределяются уровни промежуточных состояний. Распределение молекул воды по классам определяется больцмановским актором, степенью свободы для каждого уровня и условием, согласно которому невыгодно существование малых кластеров, т.е. условием, учитывающим кооперативный характер образования кластеров.
Теоретически рассчитанные Немети и Шерага количества Н-связей в воде при данной температуре довольно близко совпадали с количеством, установленным экспериментально по инфракрасному спектру [21]. Было также показано, что с ростом температуры заметно уменьшается средняя величина кластеров - если при ОсС она достигает 90 молекул, то при 70оС снижается до 25 молекул. Таким образом, с ростом температуры происходит как бы «оплавление» кластера
Очевидно, что произведение средней энергии одного моля связей Еh на производную количества имеющихся связей по температуре, должно соответствовать вкладу теплоты «оплавлении» кластеров в общую теплоемкость воды. Судя по данным [21]. Этот вклад составляет примерно 6, 7 кал/град*моль, т.е. более чем треть от полной теплоемкости воды -18 кал/град*моль.
Теплотой «подплавления» Н-связей и объясняется исключительно большая теплоемкость воды по сравнению с теплоемкостью других жидкостей.
