
- •Шпоры по зоСу (Технология защиты окружающей среды)
- •1. Приемы подавления эмиссии сернистого ангидрида в агрегатах (факелах, топках) сжигания топлива.
- •3. Аммиачно-автоклавный метод очистки отходящих газов от диоксида серы
- •4. Аммиачно-циклический метод очистки отходящих газов от диоксида серы
- •4. Аммиачно-циклический метод очистки отходящих газов от диоксида серы
- •5. Окисно-марганцевый метод очистки отходящих газов от диоксида серы
- •6. Известковый и магнезитовый методы очистки отходящих газов от диоксида серы.
- •7.Очистка газов от диоксида серы цинковым методом
- •10.Каталитическая очистка газов от диоксида серы
- •11. Адсорбционные методы очистки газов от диоксида серы
- •13.Селективное каталитическое восстановление оксидов азота.
- •15. Хемосорбционная очистка отходящих газов от оксидов азота
- •16.Адсорбционная очистка отходящих газов от оксидов азота
- •19. Улавливание аммиака водными растворами кислот и солей
- •20. Сухие способы улавливания аммиака из отходящих газов
- •21. Приемы дезодорации вентиляционных выбросов
- •22. Приемы удаления из отходящих газов фтора и его соединений
- •25. Физич. Методы рекуперации паров летучих орг. Раст-лей.
- •2 6. Типы, устройство и принципы функционирования адсорберов для очистки газов от паров органических соединений
- •27. Активные угли как средства очистки отходящих газов
- •28. Приемы десорбции поглощенных адсорбентами целевых компонентов.
- •29. Высокотемпературное обезвреживание газовых выбросов, содержащих пары органических соединений.
- •30.Каталитическая очистка газов от органических веществ
- •31. Классификация воды по видам использования
- •32. Классификация методов очистки промышленных сточных вод.
- •33.Показатели эффективности очистки сточных вод: понятия пдк и пдс, степень очистки, контроль биосферы...
- •34.Схемы оборотных и замкнутых систем водоснабжения.
- •35.Очистка сточных вод процеживанием. Схема и принцип действия решётки, расчёт её гидравлического сопротивления.
- •36.Схема и принцип действия горизонтального отстойника.
- •37. Схема и принцип действия вертикального отстойника.
- •38.Схема и принцип работы, размеры, производительность радиального отстойника.
- •39. Схема и принцип действия нефтеловушки.
- •41. Очистка сточных вод в барабанных вакуум-фильтрах – схема и принцип действия аппарата.
- •42. Схема и принцип действия однослойного скоростного фильтра периодического действия. Чем от него отличается многослойный фильтр?
- •43. Очистка сточных вод от нефти в фильтрах с пенополиуретановым слоем – схема и принцип действия аппарата.
- •44. Очистка сточных вод в напорных гидроциклонах (схема и принцип действия). От каких факторов зависит эффективность очистки воды в этих аппаратах?
- •46. Выбрать конструкцию открытого гидроциклона для очистки сточной воды с гидравлической крупностью 0,1 мм/с. Начертить схему гидроциклона и объяснить принцип работы.
- •47. Нейтрализация
- •52. Очистка от соединений ртути.
- •54.Химическая очистка сточных вод от соединений меди и цинка (пдКв Cu -0,1мг/л, Zn – 1,0)
- •55.Химическая очистка сточных вод от соединений железа с использованием кислорода воздуха, хлора, озона. Уравнения и условия реакций.
- •56.Физико-химические основы очистки сточных вод коагуляцией и флокуляцией. В чём заключаются сходства и различия этих методов?
- •57.Схема очистки сточных вод коагуляцией / флокуляцией. Виды коагулянтов (Al- и Fe- содержащие) и флокулянтов (природные и синтетические).
- •59. Виды камер хлопьеобразования коагулянта с водой. Изобразить схемы вихревой и водоворотной камер хлопьеобразования.
- •60. Принцип метода и схема установки пенной сепарации для очистки сточных вод от пав.
- •61. Физико-химические основы (описать механизм явления) и виды процесса флотации. Как влияет характер поверхности частиц на эффективность их флотации из водной среды?
- •62.Очистка сточных вод напорной и безнапорной флотацией. Схема и принцип действия соответствующих установок.
- •Вопрос 68
- •Вопрос 69 Схема и режим работы непрерывной адсорбционной установки из 3 вертикальных адсорберов с неподвижным слоем.
- •70.Схема и принцип действия адсорберов с движущимся и псевдоожиженным слоем адсорбента (с выносным смесителем или переливными трубами).
- •71. Основы ионообменной очистки сточных вод (что такое ионный обмен и иониты, ответ проиллюстрировать уравнениями реакций ионного обмена). Виды ионитов по происхождению и кислотно-основным свойствам.
- •72. Что такое изотерма ионного обмена? Что означают полная, статическая и динамическая обменные ёмкости ионита? Стадии процесса ионного обмена. Определение лимитирующей стадии по критерию Био.
- •73.Очистка сточных вод в ионообменных установках с неподвижным слоем ионита (схема и принцип действия). Как проводят регенерацию катионитов (перевод в h-форму) и анионитов (перевод в oh-форму)?
- •74. Очистка сточных вод в установках с движущимся и псевдоожиженным слоем ионита (схема и принцип действия).
- •75. Принцип очистки сточных вод экстракцией. Стадии экстракционной очистки. Главные требования к экстрагентам для очистки сточных вод.
- •76. Схема и принцип действия многоступенчатой противоточной экстракционной установки. Какие методы применяют для регенерации экстрагента?
- •77. Суть процессов обратного осмоса и ультрафильтрации, их сходства и различия. Общая схема установки обратного осмоса. Перечислить аппараты обратного осмоса по способу укладки мембран.
- •78. Основы метода дезодорации: какие загрязнения удаляются, какие процессы используются для их удаления, какой из них наиболее распространен? Привести схему простейшей установки для дезодорации.
- •87.Общая схема аэробной очистки сточных вод в аэротенках. Какие аэротенки бывают по гидродинамическому режиму?
- •88. Схема и принцип действия двухступенчатых установок для очистки сточных вод в аэротенках (1 – с регенератором, 2 – без регенератора).
- •89.Очистка сточных вод в биофильтрах (принцип и особенности процесса по сравнению с очисткой в аэротенках). Какие биофильтры бывают по конструкции?
- •90. На каком процессе основаны анаэробные методы очистки сточных вод? Схема и принцип действия метантенка для анаэробной очистки сточных вод.
6. Известковый и магнезитовый методы очистки отходящих газов от диоксида серы.
Магнезитовый метод. Диоксид серы в этом случае поглощают оксид-гидрооксидом магния. В процессе хемосорбции образуются кристаллогидраты сульфита магния, которые сушат, а затем термически разлагают на 802-содержащий газ и оксид магния. Газ перерабатывают в серную кислоту, а оксид магния возвращают на абсорбцию.
В абсорбере протекают следующие реакции:
MgO+H2O = Mg(OH)2,
MgSO3+H2O+SO2 =Mg(HSO3)2
Mg(HSO3)2+Mg(OH)2 = 2MgSO3+2H2O.
Растворимость сульфита магния в воде ограничена, избыток его в виде MgSO3∙6H20 и MgSO3∙3Н2О выпадает в осадок. Технологическая схема процесса представлена на рис. 1-26, б.
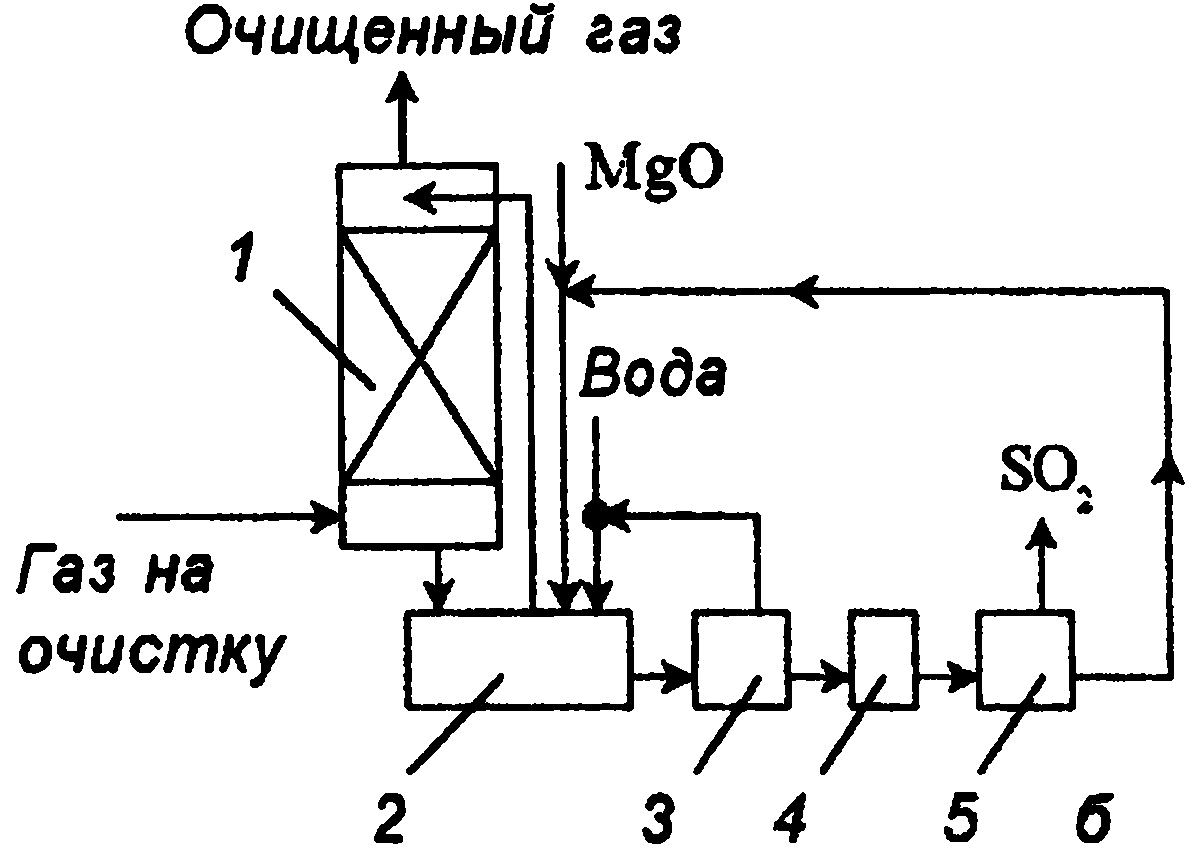 1-
абсорбер, 2 нейтрализатор, 3 – центрифуга,
4 – сушилка, 5 - печь
1-
абсорбер, 2 нейтрализатор, 3 – центрифуга,
4 – сушилка, 5 - печь
Дымовые газы поступают в абсорбер Вентури, орошаемый циркулирующей суспензией. Отношение Т:Ж в суспензии 1:10, рН суспензии на входе 6,8-7,5, а на выходе из абсорбера 5,5-6. Состав циркулирующей суспензии (в %): MgO — 1,4; MgSO3 — 6,7; MgS04 — 12,4; вода и примеси — 79,65.
В абсорбере кроме сульфита образуется некоторое количество сульфата:
2MgSO3+O2=2MgSO4.
Образование сульфата нежелательно, так как для его разложения необходима более высокая температура (1200-1300 °С). При таких условиях получается переобожженный MgO, который имеет малую активность по отношению к SO2. Для устранения образования сульфата необходимо использовать ингибиторы окисления или проводить процесс в абсорберах при малом времени контакта газ — жидкость. Другой путь—производить обжиг сульфата в присутствии восстановителей (кокса, метана, оксида углерода и др.). В этом случае сульфат восстанавливается в сульфид.
Из нейтрализатора часть суспензии выводят на центрифугу для отделения кристаллогидратов солей магния. Обезвоживание солей производят в сушилках барабанного типа с мазутной топкой. Продукт после сушки содержит (в %): MgO — 2,6; MgSO3 — 65,0; MgSO4— 11,8; Н2О — 20,6. Безводные кристаллы обжигают во вращающихся печах или печах кипящего слоя при 900°С, в печь добавляют кокс. При этом идет реакция:
MgSO3->MgO+SO2.
Концентрация SO2 в газе, выходящем из печи, 7-15%. Газ охлаждают, очищают от пыли и сернокислотного тумана и направляют на переработку в серную кислоту.
Выгружаемый из печи продукт содержит 86,1% MgO и 3,4% MgSO4. Его охлаждают до 120°С воздухом, идущим на сгорание мазута в топках, после чего отправляют на абсорбцию.
Достоинства магнезитового метода: 1) возможность очищать горячие газы без предварительного охлаждения; 2) получение в качестве продукта рекуперации серной кислоты; 3) доступность и дешевизна хемосорбента; высокая эффективность очистки.
Недостатки: 1) сложность технологической схемы; 2) неполное разложение сульфата магния при обжиге; 3) значительные потери оксида магния при регенерации.

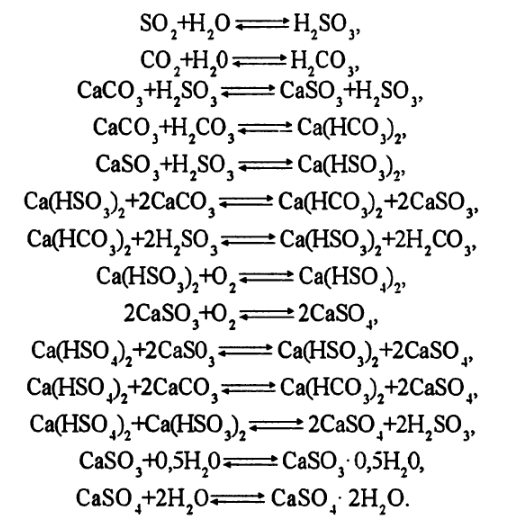

7.Очистка газов от диоксида серы цинковым методом
Абсорбентом служит суспензия оксида цинка, при этом идет реакция: SO2+ZnO+2,5H2O = ZnSO3 • 2,5Н2О.
При большой концентрации О2 в газе может протекать реакция: 2SO2 + ZnO + H2O = Zn(HSO3)2
Образующийся сульфит цинка нерастворим в воде, его отделяют в гидроциклонах, а затем сушат и обжигают при 350°С. Сульфит цинка разлагается по реакции:
ZnSO3*2,5H20=ZnO+SO2+2,5H2O.
Образующийся диоксид серы перерабатывают, а оксид цинка возвращают на абсорбцию. Достоинством метода является возможность проводить процесс очистки при высокой температуре (100-250 °С). Недостаток — образование сульфата цинка, который экономически не целесообразно подвергать регенерации, а необходимо непрерывно выводить из системы и добавлять в нее эквивалентное количество диоксида цинка.
8. Абсорбция диоксида серы из газов расплавленными солями.
Для очистки газов при высокой температуре используется эвтектическая смесь карбонатов щелочных металлов состава (в %): LiСО3 — 32; Na2CO3 — 33; К2СО3 — 35. Точка плавления смеси 397°С При 425°С смесь имеет вязкость 0,012 Па с и плотность 2000 кг/м3. При содержании SO2 в газе от 0,3 до 3% смесь абсорбирует 99% SO2 Процесс состоит из стадий абсорбции, восстановления и регенерации абсорбента. Абсорбция SO2 производится карбонатами с образованием сульфитов и сульфатов металлов. Скорости реакций очень велики, поэтому процесс лимитируется скоростью переноса диоксида серы. Абсорбцию проводят в оросительном скруббере при скорости газа 7,5 м/с. Реакции, проходящие в скруббере, экзотермичны, что позволяет частично компенсировать потерю тепла. На стадии восстановления используют генераторный газ. Процесс проводят при 600°С. Происходит восстановление сульфатов до сульфидов металлов: 4Me2SO3=3Me2SO4+Me2S
Me2S04+4H2=Me2S+4H2O,
Me2SO4+4CO=Me2S+4CO2
Реакции восстановления протекают медленно. На стадии регенерации сульфиды реагируют со смесью СО2 и воды при 425°С: Me2S+CO2+H20=Me2CO3+H2S.
Реакция протекает быстро. Полученный расплав солей вновь возвращают в процесс. Газ, выходящий из реактора регенерации, содержит 30% H2S, оксид углерода и воду. Его направляют на установку, работающую по методу Клауса, для получения серы. Формиат калия можно применять как абсорбент в виде расплава при 177°С или в виде водного раствора при 93°С. 90 Последовательность реакций, протекающих в процессе очистки: абсорбция (в водном растворе) 2HCOOK+2SO2=K2S203+2CO2+H2O,
регенерация
4HCOOK+K2S203=2K2C03+2KHS+2CO2+H20,
2KHS+CO2=K2CO3+2H2S,
К2С03+2СО+Н20=2КСООН+СО2.
Сероводород рекуперируется в виде серы.
9. Двуступенчатая схема очистки газа с окислением сульфита кальция. Нерекуперационные методы.
Для приготовления суспензии применяется измельченный известняк с размером частиц 0,1 мм. Состав суспензии Т:Ж= 1:10. Предложено несколько схем очистки газов. Абсорбер орошается суспензией с рН=6-6,2. Шлам из абсорбера частично поступает в циркуляционный сборник, куда подается свежий известняк, а частично направляется на отделение воды в центрифугу или на фильтр. Степень очистки достигает 85%. Коэффициент использования извести 50%.
На электростанциях мощностью 1000 МВт ежегодно образуется шлама 780 т/год на 1 МВт. Шлам содержит сульфит кальция и до 65% воды. Сульфит кальция мелкокристалличен, гигроскопичен и способен поглощать кислород. В нерекуперационных установках шлам захоранивают. Для этого суспензию сгущают до содержания твердой фазы 250-300 г/л, перекачивают насосом по трубам из полимерных материалов в накопитель шлама, затем подвергают захоронению.
Производство сульфата кальция (гипса) из шлама состоит из следующих стадий; 1) корректировка рН раствора серной кислотой; 2) окисление сульфита в сульфат воздухом при повышенных давлениях; 3) отстаивание; 4) центрифугирование.
Сточные воды после отстаивания и центрифугирования представляют собой сильную кислоту. Их нейтрализуют гидроксидом кальция (известковым молоком) или раствором NaOH, затем фильтруют через грунт, освобождая от твердых частиц. Состав продукта в расчете на сухое вещество, в %: CaSO4-2H2O — 95,0; CaSO3— 0,8; СаСО3 — 1,9; зола и другие компоненты — 2,3.
Окисление шлама экономически оправдано даже в тех случаях, когда выпуск товарного гипса не предусмотрен, так как скорость обезвоживания окисленного шлама значительно выше, чем неокисленного, что позволяет сократить затраты на оборудование. Предложены одноступенчатые и двухступенчатые схемы очистки с окислением сульфита кальция, содержащегося в шламе, в сульфат.
Для окисления в сборник подают воздух. Для завершения процессов кристаллизации циркулирующую жидкость выдерживают в сборниках.
В результате шлам представляет смесь CaSO4-2H2O и CaSO3·0,5H2O. Более глубокая очистка достигается на двухступенчатых установках. Первая ступень орошается суспензией с рН = 4,5-5, вторая — рН = 6. Гипс отделяют на центрифугах или фильтрах. Он может содержать CaSO30,5H2O. Для перевода сульфита в сульфат добавляют серную кислоту. Недостатки известковых и известняковых методов следующие: происходит зарастание систем отложениями гипса, коррозия и эрозия оборудования, значительный брызгоунос из абсорберов, образование осадков. Для устранения отложений CaSO4 предусматривают: повышение отношения жидкость/газ с целью уменьшения пересыщения раствора сульфитом кальция; рециркуляцию твердого сульфата кальция с поглощающей жидкостью для образования центров кристаллизации; увеличение продолжительности выдерживания циркулирующей жидкости вне абсорбера для завершения процессов кристаллизации; поддержание необходимого рН раствора с целью уменьшения степени окисления сульфита кальция в сульфат; протекание раствора, со держащего кристаллы CaSO4, через осадок сульфита кальция для уменьшения степени насыщения раствора по гипсу; добавление ионов Сl- к жидкости, что повышает растворимость кальциевых солей и тем самым уменьшает зарастание аппаратов.
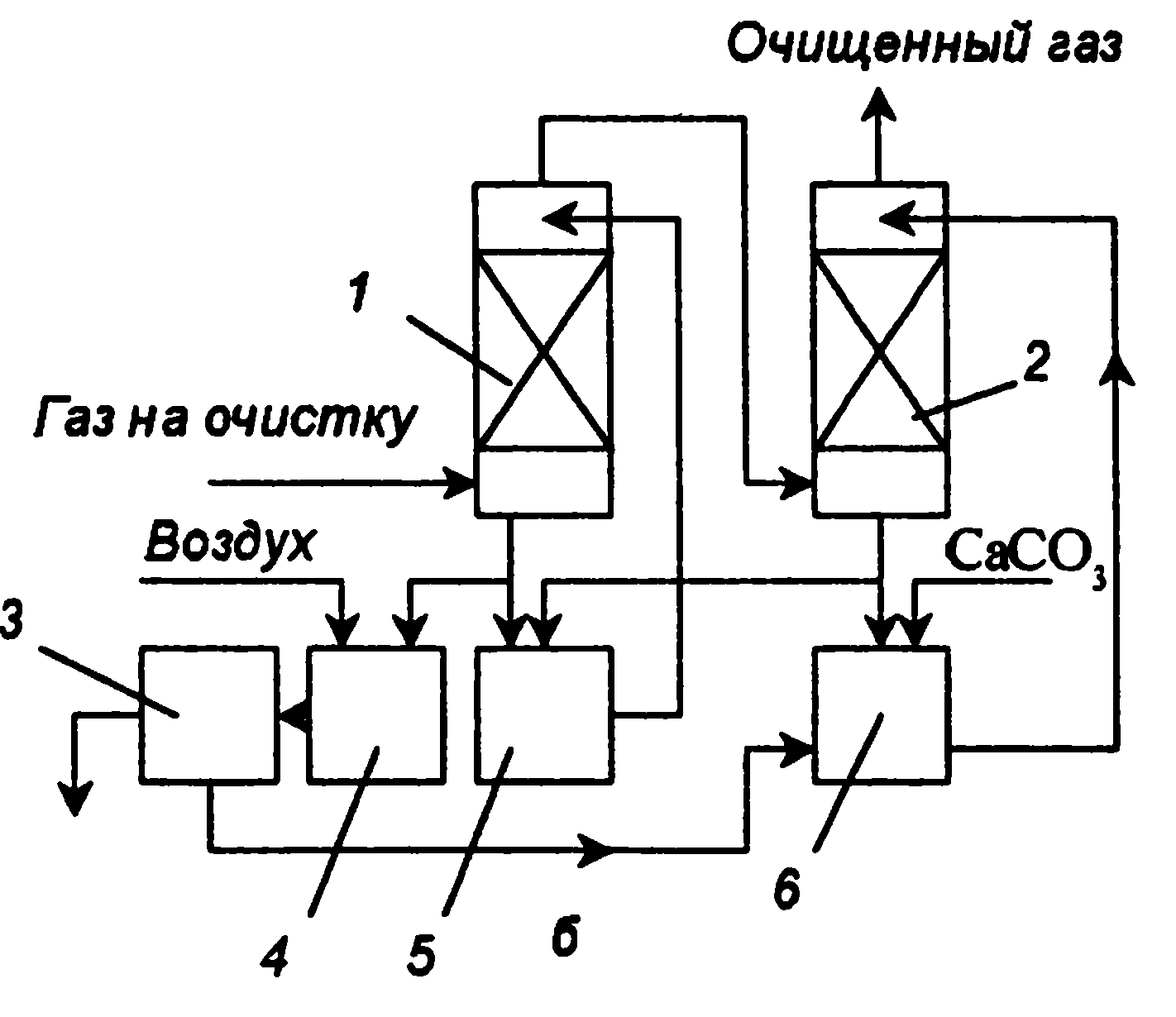
б — двухступенчатая: 1,2 — абсорберы, 3 — центрифуга, 4—6 –сборники
