- •Шпоры по зоСу (Технология защиты окружающей среды)
- •1. Приемы подавления эмиссии сернистого ангидрида в агрегатах (факелах, топках) сжигания топлива.
- •3. Аммиачно-автоклавный метод очистки отходящих газов от диоксида серы
- •4. Аммиачно-циклический метод очистки отходящих газов от диоксида серы
- •4. Аммиачно-циклический метод очистки отходящих газов от диоксида серы
- •5. Окисно-марганцевый метод очистки отходящих газов от диоксида серы
- •6. Известковый и магнезитовый методы очистки отходящих газов от диоксида серы.
- •7.Очистка газов от диоксида серы цинковым методом
- •10.Каталитическая очистка газов от диоксида серы
- •11. Адсорбционные методы очистки газов от диоксида серы
- •13.Селективное каталитическое восстановление оксидов азота.
- •15. Хемосорбционная очистка отходящих газов от оксидов азота
- •16.Адсорбционная очистка отходящих газов от оксидов азота
- •19. Улавливание аммиака водными растворами кислот и солей
- •20. Сухие способы улавливания аммиака из отходящих газов
- •21. Приемы дезодорации вентиляционных выбросов
- •22. Приемы удаления из отходящих газов фтора и его соединений
- •25. Физич. Методы рекуперации паров летучих орг. Раст-лей.
- •2 6. Типы, устройство и принципы функционирования адсорберов для очистки газов от паров органических соединений
- •27. Активные угли как средства очистки отходящих газов
- •28. Приемы десорбции поглощенных адсорбентами целевых компонентов.
- •29. Высокотемпературное обезвреживание газовых выбросов, содержащих пары органических соединений.
- •30.Каталитическая очистка газов от органических веществ
- •31. Классификация воды по видам использования
- •32. Классификация методов очистки промышленных сточных вод.
- •33.Показатели эффективности очистки сточных вод: понятия пдк и пдс, степень очистки, контроль биосферы...
- •34.Схемы оборотных и замкнутых систем водоснабжения.
- •35.Очистка сточных вод процеживанием. Схема и принцип действия решётки, расчёт её гидравлического сопротивления.
- •36.Схема и принцип действия горизонтального отстойника.
- •37. Схема и принцип действия вертикального отстойника.
- •38.Схема и принцип работы, размеры, производительность радиального отстойника.
- •39. Схема и принцип действия нефтеловушки.
- •41. Очистка сточных вод в барабанных вакуум-фильтрах – схема и принцип действия аппарата.
- •42. Схема и принцип действия однослойного скоростного фильтра периодического действия. Чем от него отличается многослойный фильтр?
- •43. Очистка сточных вод от нефти в фильтрах с пенополиуретановым слоем – схема и принцип действия аппарата.
- •44. Очистка сточных вод в напорных гидроциклонах (схема и принцип действия). От каких факторов зависит эффективность очистки воды в этих аппаратах?
- •46. Выбрать конструкцию открытого гидроциклона для очистки сточной воды с гидравлической крупностью 0,1 мм/с. Начертить схему гидроциклона и объяснить принцип работы.
- •47. Нейтрализация
- •52. Очистка от соединений ртути.
- •54.Химическая очистка сточных вод от соединений меди и цинка (пдКв Cu -0,1мг/л, Zn – 1,0)
- •55.Химическая очистка сточных вод от соединений железа с использованием кислорода воздуха, хлора, озона. Уравнения и условия реакций.
- •56.Физико-химические основы очистки сточных вод коагуляцией и флокуляцией. В чём заключаются сходства и различия этих методов?
- •57.Схема очистки сточных вод коагуляцией / флокуляцией. Виды коагулянтов (Al- и Fe- содержащие) и флокулянтов (природные и синтетические).
- •59. Виды камер хлопьеобразования коагулянта с водой. Изобразить схемы вихревой и водоворотной камер хлопьеобразования.
- •60. Принцип метода и схема установки пенной сепарации для очистки сточных вод от пав.
- •61. Физико-химические основы (описать механизм явления) и виды процесса флотации. Как влияет характер поверхности частиц на эффективность их флотации из водной среды?
- •62.Очистка сточных вод напорной и безнапорной флотацией. Схема и принцип действия соответствующих установок.
- •Вопрос 68
- •Вопрос 69 Схема и режим работы непрерывной адсорбционной установки из 3 вертикальных адсорберов с неподвижным слоем.
- •70.Схема и принцип действия адсорберов с движущимся и псевдоожиженным слоем адсорбента (с выносным смесителем или переливными трубами).
- •71. Основы ионообменной очистки сточных вод (что такое ионный обмен и иониты, ответ проиллюстрировать уравнениями реакций ионного обмена). Виды ионитов по происхождению и кислотно-основным свойствам.
- •72. Что такое изотерма ионного обмена? Что означают полная, статическая и динамическая обменные ёмкости ионита? Стадии процесса ионного обмена. Определение лимитирующей стадии по критерию Био.
- •73.Очистка сточных вод в ионообменных установках с неподвижным слоем ионита (схема и принцип действия). Как проводят регенерацию катионитов (перевод в h-форму) и анионитов (перевод в oh-форму)?
- •74. Очистка сточных вод в установках с движущимся и псевдоожиженным слоем ионита (схема и принцип действия).
- •75. Принцип очистки сточных вод экстракцией. Стадии экстракционной очистки. Главные требования к экстрагентам для очистки сточных вод.
- •76. Схема и принцип действия многоступенчатой противоточной экстракционной установки. Какие методы применяют для регенерации экстрагента?
- •77. Суть процессов обратного осмоса и ультрафильтрации, их сходства и различия. Общая схема установки обратного осмоса. Перечислить аппараты обратного осмоса по способу укладки мембран.
- •78. Основы метода дезодорации: какие загрязнения удаляются, какие процессы используются для их удаления, какой из них наиболее распространен? Привести схему простейшей установки для дезодорации.
- •87.Общая схема аэробной очистки сточных вод в аэротенках. Какие аэротенки бывают по гидродинамическому режиму?
- •88. Схема и принцип действия двухступенчатых установок для очистки сточных вод в аэротенках (1 – с регенератором, 2 – без регенератора).
- •89.Очистка сточных вод в биофильтрах (принцип и особенности процесса по сравнению с очисткой в аэротенках). Какие биофильтры бывают по конструкции?
- •90. На каком процессе основаны анаэробные методы очистки сточных вод? Схема и принцип действия метантенка для анаэробной очистки сточных вод.
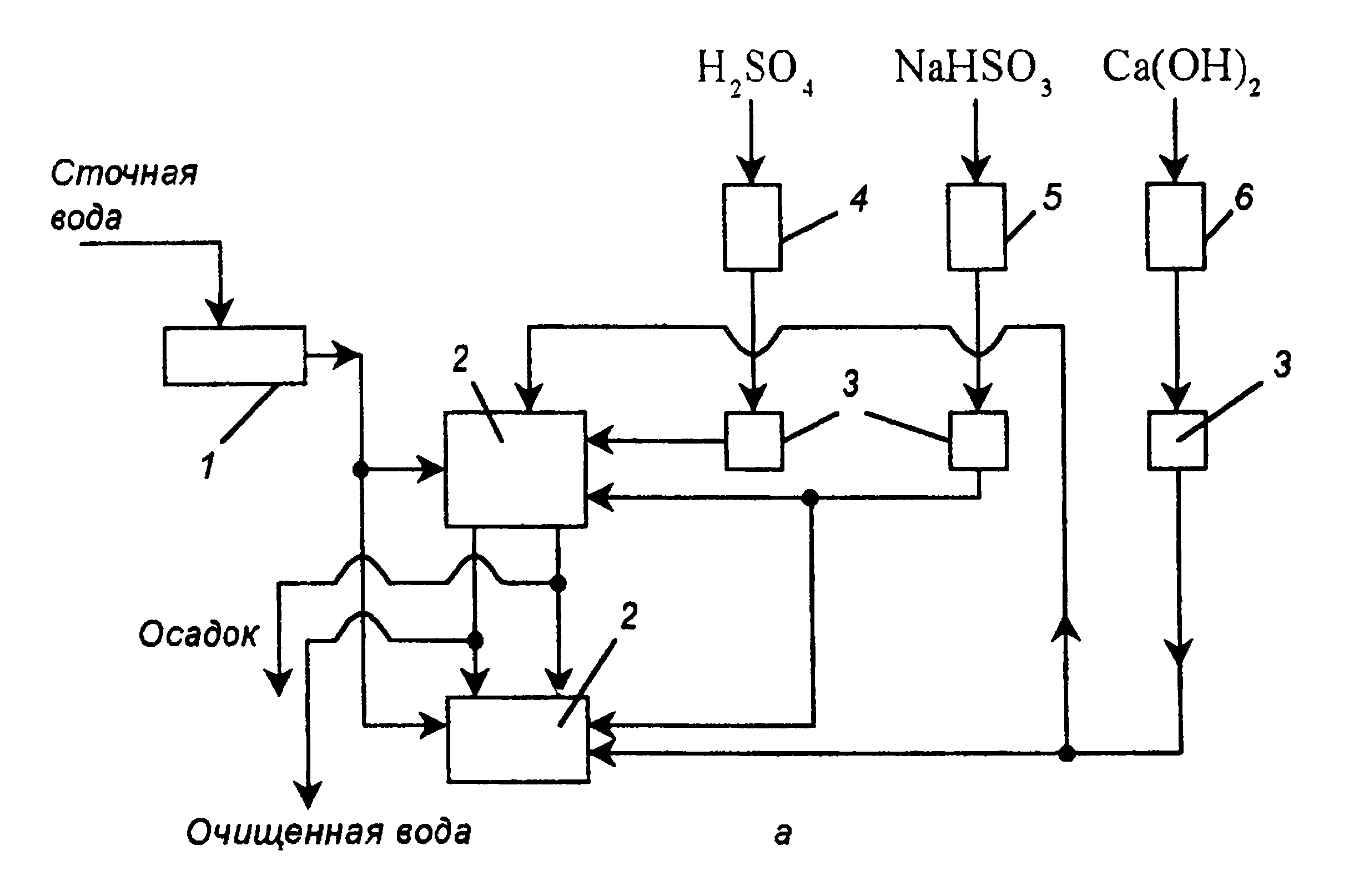
46. Выбрать конструкцию открытого гидроциклона для очистки сточной воды с гидравлической крупностью 0,1 мм/с. Начертить схему гидроциклона и объяснить принцип работы.
Два вида открытых гидроциклона: с внутренними устройствами и без внутренних устройств. Без внутренних устройств годится только для сточных вод с гидравлической крупностью Woc > 5 мм / с. С внутренними устройствами Woc < 0.2 мм / с — то что нам нужно.

1 — корпус, 2 — внутренний цилиндр, 3 — кольцевой лоток,
4 — диафрагма;
Сточную воду тангенциально подают в пространство, ограниченное внутренним цилиндром 2. Поток по спирали движется вверх. Дойдя до верха цилиндра, он разделяется на два потока. Один из них (осветленная вода) движется к центральному отверстию диафрагмы 4 и, пройдя ее, попадает в лоток 3. Другой поток, со взвешенными частицами, направляется в пространство между стенками корпуса 1 и внутреннего цилиндра 2 и поступает в коническую его часть.
Эффективность 70-80%
47. Нейтрализация
Сточные воды, содержащие минеральные кислоты или щелочи,
перед сбросом их в водоемы или перед использованием в технологических процессах нейтрализуют. Практически нейтральными считаются воды, имеющие рН = 6,5-8,5.
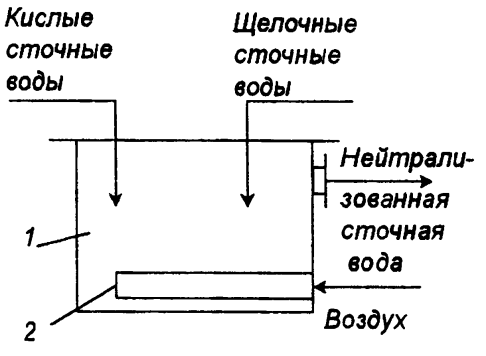
Нейтрализация смешиванием. Этот метод применяют, если на одном предприятии или на соседних предприятиях имеются кислые и щелочные воды, не загрязненные другими компонентами. Кислые и щелочные воды смешивают в емкости (рис. П-54) с мешалкой и без мешалки. В последнем случае перемешивание ведут воздухом при его скорости в линии подачи 20-40 м/с. При переменной концентрации сточных вод в схеме предусматривают установку усреднителя или обеспечивают автоматическое регулирование подачи в камеру смешивания. Расчет соотношения сточных вод, направляемых в камеру смешения, проводят по стехиометрическим уравнениям.
Рис. П-54 Нейтрализатор смешения.
Нейтрализация путем добавления реагентов. Для нейтрализации кислых вод могут быть использованы: NaOH, КОН, NaoC03, NH4OH (аммиачная вода), СаСО3, MgCO3, доломит (СаСО3 MgCO3), цемент. Однако наиболее дешевым реагентом является гидроксид кальция (известковое молоко) с содержанием активной извести Са(ОН) 5-10%. Соду и гидроксид натрия следует использовать, если они являются отходами производства. Иногда для нейтрализации применяют различные отходы производства. Например, шлаки сталеплавильного, феррохромового и доменного производств используют для нейтрализации вод, содержащих серную кислоту. Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. При этом учитывают, будет ли в процессе образовываться осадок или нет. Различают три вида кислотосодержащих сточных вод: 1) воды, содержащие слабые кислоты (Н2СО3, СН3СООН); 2) воды, содержащие сильные кислоты (НС1, HNO3). Для их нейтрализации может быть использован любой названный выше реагент. Соли этих кислот хорошо растворимы в воде; 3) воды, содержащие серную и сернистую кислоты. Кальциевые соли этих кислот плохо растворимы в воде и выпадают в осадок. Известь для нейтрализации вводят в сточную воду в виде гидроксида кальция (известкового молока; "мокрое дозирование") или в виде сухого порошка ("сухое" дозирование). Схема установки для нейтрализации кислых вод известковым молоком показана на рис. И-56. Для гашения извести используют шаровые мельницы мокрого помола, в которых одновременно происходят тонкое измельчение и гашение. Для смешения сточных вод с известковым молоком применяют гидравлические смесители различных типов: дырчатые, перегородчатые, вихревые, с механическими мешалками или барботажные с расходом воздуха 5-10 м3/ч на 1 м2 свободной поверхности.
При нейтрализации сточных вод, содержащих серную кислоту; известковым молоком в осадок выпадает гипс CaSO4 2H2O. Растворимость гипса мало меняется с температурой. При перемещении таких растворов происходит отложение гипса на стенках трубопроводов и их забивка. Для устранения забивки трубопровода необходимо промывать их чистой водой или добавлять в сточные воды специальные умягчители, например гексаметафосфат. Увеличение скорости движения нейтрализованных вод способствует уменьшению отложений гипса на стенках трубопровода. Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы.
Нейтрализация кислыми газами. Для нейтрализации щелочных сточных вод в последнее время начинают использовать отходящие газы, содержащие СО2, SO2, NO2, N2O3 и др. Применение кислых газов позволяет не только нейтрализовать сточные воды, но и одновременно производить высокоэффективную очистку самих газов от вредных компонентов. Использование для нейтрализации щелочных сточных вод СО2 имеет ряд преимуществ по сравнению с применением серной или соляной кислот, позволяет резко снизить стоимость процесса нейтрализации. Вследствие плохой растворимости СО2 уменьшается опасность переокисления нейтрализованных растворов.
Образующиеся карбонаты находят большее применение по сравнению с сульфатами или хлоридами, кроме того коррозионные и токсичные воздействия СО32~ ионов в воде меньше, чем ионов SO4 и С13.
Процесс нейтрализации может быть проведен в реакторах с мешалкой (рис. П-57), в распылительных, пленочных и тарельчатых колоннах.
Дымовые газы вентилятором подают в кольцевое пространство вокруг вала мешалки и распределяют мешалкой в виде тзырьков и струй в сточной воде, поступающей внутрь реактора. Благодаря большой поверхности контакта между водой и газами происходит быстрая нейтрализация сточной воды. Присутствие в газах SO2 способствует нейтрализации щелочных сточных вод. При проведении процесса в тарельчатых колоннах степень нейтрализации увеличивается с ростом скорости газа и уменьшением плотности орошения. Нейтрализация щелочных вод дымовыми газами использована в ряде производств, в том числе и в асбестоцементном производстве. Сточные воды этих производств имеют рН = 12-13 («80 мг-экв/л). Щелочность воды обусловлена постоянным выщелачиванием в нее гидроксида кальция. Нейтрализацию проводили диоксидом углерода дымовых газов E-6 % СО2) в тарельчатом абсорбере. Особенностью нейтрализации дымовыми газами сточных вод асбестоцементного предприятия является образование карбоната кальция, который может находиться в состоянии пересыщения и отлагается на внутренней поверхности оборудования.
В смесителе протекают следующие реакции:
ОН + НСО3=Н2О + СО3,
С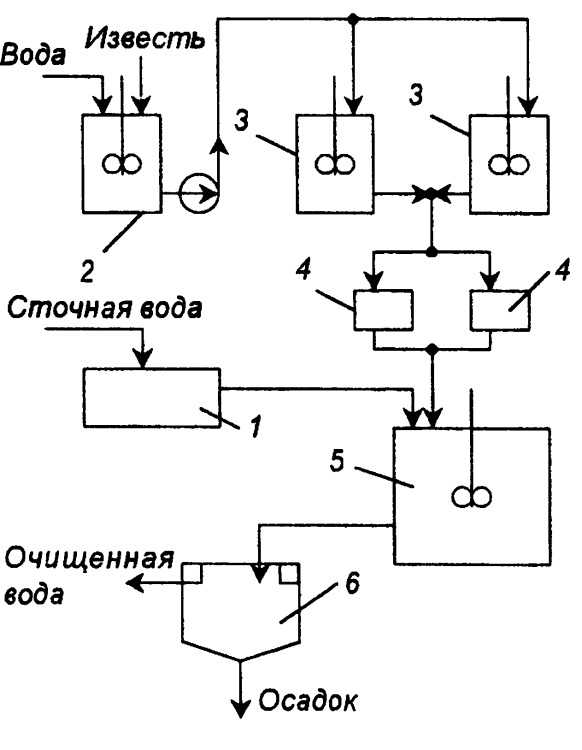 а2+
СО3=СаСО3
а2+
СО3=СаСО3
Рис П-56. Схема установки
нейтрализации кислых сточных вод гидроксидом кальция (известковым молоком)1 — усреднитель, 2 — аппарат для гашения извести (СаО); 3 — растворные баки; 4 — дозаторы; 5 — нейтрализаторы; 6 — отстойник
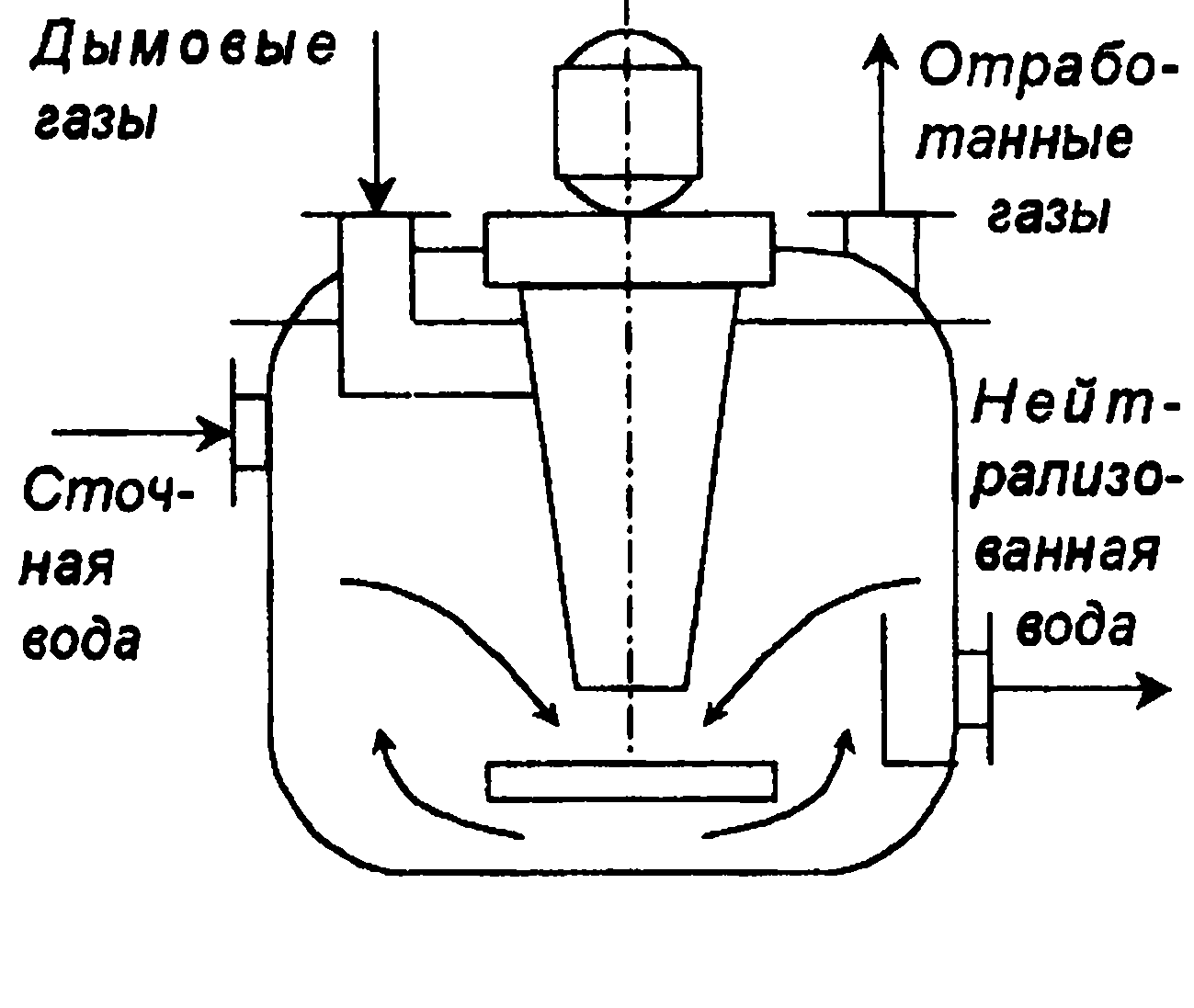
Рис.II-57- Нейтрализатор щелочных сточных вод дымовыми газами
48. Окисление хлором.
Хлор и вещества, содержащие "активный" хлор, являются наиболее распространенными окислителями. Их используют для очистки сточных вод от сероводорода, гидросульфида, метилсернистых соединений, фенолов, цианидов и др. При введении хлора в воду образуются хлорноватистая [оксохлорат (I) водорода] и соляная (хлороводородная) кислоты: С12+Н2О = НОС1 + НС1
Далее происходит диссоциация хлорноватистой кислоты, степень которой зависит от рН среды. При рН = 4 молекулярный хлор практически отсутствует: HOCI=H+ОCl
Сумма С12 + НОС1 + ОС1 называется свободным "активным" хлором.
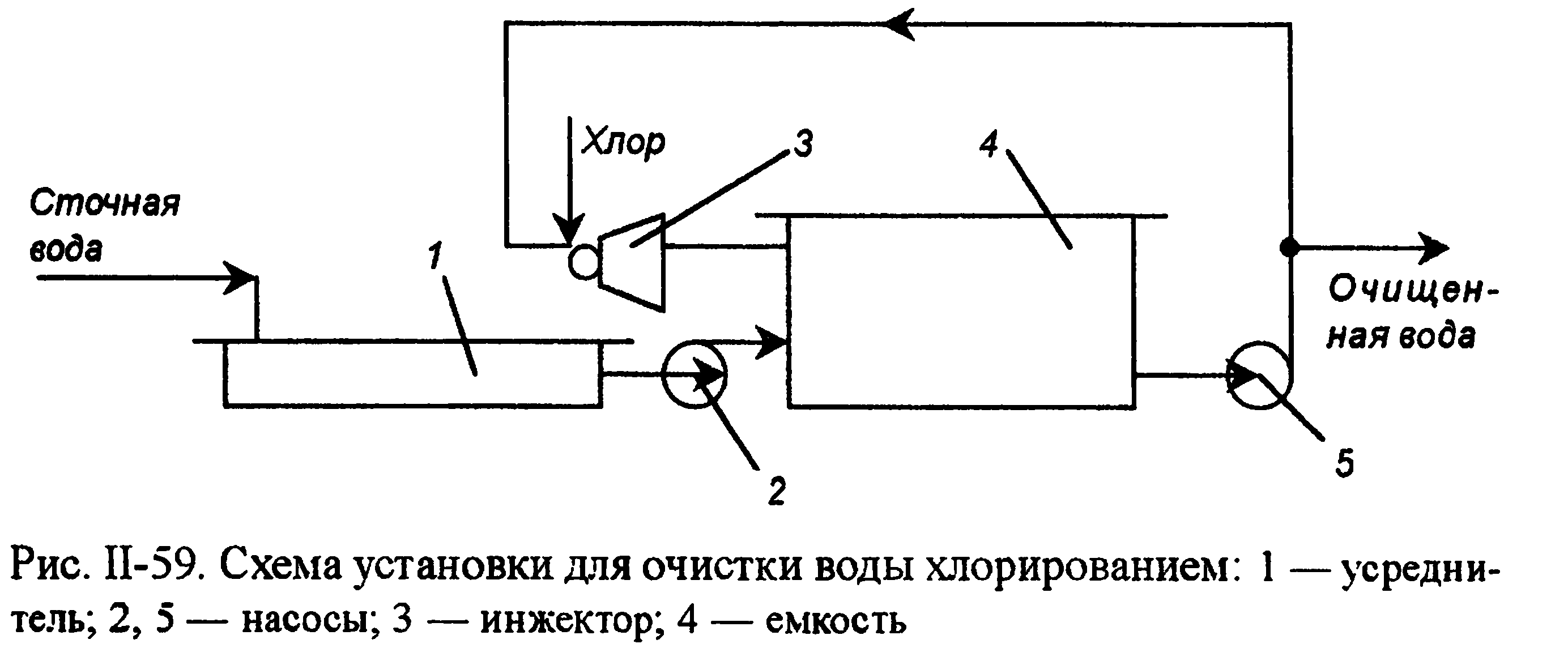
В присутствии аммонийных соединений в воде образуется хлорноватистая кислота, хлорамин NH2C1 и дихлорамин NHCL,. Хлор в виде хлорамина называется связанным "активным" хлором. Процесс хлорирования проводят в хлораторах периодического и непрерывного действия, напорных и вакуумных. Принципиальная схема очистки вод хлорированием показана на рис. П-59. Хлорирование проводится в емкости, включенной в систему циркуляции. В инжекторе газообразный хлор захватывается сточной водой,
циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления, после чего вода выводится для использования. При обезвреживании вод от цианидов процесс проводят в щелочной среде (рН = 9). Цианиды можно окислить до элементного азота и диоксида углерода по уравнениям: CN- + 2ОН- + C12=CNO- + 2С1- + Н2О,
2CNO- + 4ОН- + ЗС12-=СО2 + 6С + N2+ 2Н2О
Источниками "активного" хлора могут быть также хлорат кальция, гипохлориты, хлораты, диоксид хлора. Хлорат кальция (хлорную известь) получают при взаимодействии: Са(ОН)+С12 = СаОС12+Н2О.
Гипохлорит (оксохлорат) натрия образуется при протекании газообразного хлора через раствор щелочи: С12 + 2NaOH = NaCIO + NaCl.
Гипохлорит кальция приготовляют хлорированием гидроксида кальция при температуре 25~30°С:
Са(ОН) + 2С12 = Са(СЮ) + СаС12 + 2Н2О.
Промышленность выпускает двухосновную соль Са(С1О2)•2Са(ОН)2Н2О.
Сильным окислителем является хлорат натрия NaC1О2 который
разлагается с выделением СlO2. Диоксид хлора — зеленовато-желтый ядовитый газ, обладающий более интенсивным запахом, чем хлор. Для его получения проводят следующие реакции:
2NaC1O2 + Сl2=2СlO2 + 2NaCl,
5NaClO2 + 4HCl=5NaCl + 4С1О2 + 2Н2О.
При окислении цианидов "активным" хлором процесс можно проводить в одну ступень до получения цианатов:
CN + OCl = CNO + Cl.
49. Окисление пероксидом водорода.
Пероксид водорода является бесцветной жидкостью, в любых соотношениях смешивается с водой. Она может быть использована для окисления нитритов, альдегидов, фенолов, цианидов, серосодержащих отходов, активных красителей. Промышленность выпускает 85-95%-ный пероксид водорода и пергидроль, содержащий 30% Н2О2. Пероксид водорода токсичен. ПДК в воде составляет 0,1 мг/л. Пероксид водорода в кислой и щелочной средах разлагается по следующим схемам:
2Н+ Н2О2 + 2е=2Н2О, 2ОН- + Н2О2 + 2е=2Н2О + 2О.
В кислой среде более отчетливо выражена окислительная функция, а в щелочной — восстановительная. В кислой среде пероксид водорода переводит соли двухвалентного железа в соли трехвалентного, азотистую кислоту — в азотную, сульфиды — в сульфаты. Цианиды в цианаты окисляются в щелочной среде (рН = 9-12). В разбавленных растворах процесс окисления органических веществ протекает медленно, поэтому используют катализаторы —ионы металлов переменной валентности (Fe2+, Cu2+, Mn2+, Со2+, Cr2+, Ag+). Например, процесс окисления пероксидом водорода с солью железа протекает весьма эффективно при рН = 3-4,5. Продуктами окисления являются муконовая и малеиновая кислоты.
В процессах водообработки используют не только окислительные, но и восстановительные свойства пероксида водорода. В нейтральной и слабощелочной средах он легко взаимодействует с хлором и гипохлоритами, переводя их в хлориды:
Н2О2 + С12 = O2 +2НС1
NaC1O + Н2О2= NaC1 + O2+H2O
Эти реакции используют при дехлорировании воды. Избыток пероксида водорода можно удалять, обрабатывая его диоксидом марганца:
МпО2
+ Н2О2 + 2НС1=МпС12 + 2Н2О + ![]() .
.
50. Озонирование. Окисление озоном позволяет одновременно обеспечить обесцвечивание воды, устранение привкусов и запахов и обеззараживание. Озонированием можно очищать сточные воды от фенолов, нефтепродуктов, сероводорода, соединений мышьяка, ПАВ, цианидов, красителей, канцерогенных ароматических углеводородов, пестицидов и др.
Обеззараживающее действие озона основано на высокой окислительной способности, обусловленной легкостью отдачи им активного атома кислорода (О3 = О2 + О). Озон окисляет все металлы, кроме золота, превращая их в оксиды. При обработке воды озоном происходит разложение органических веществ и обеззараживание воды. Небольшое содержание кислот и нейтральных солей увеличивает растворимость озона. Присутствие щелочей снижает растворимость О3. Окисление веществ может быть прямое и непрямое, а также может осуществляться катализом и озонолизом. Примером прямых реакций может служить окисление ряда органических и минеральных веществ (Fe2+, Mn2+), которые после озонирования осаждаются в форме нерастворимых гидроксидов или переводятся в диоксиды и перманганаты. Непрямое окисление — окисление радикалами, например, группой ОН и другими, образующимися в результате перехода озона из газовой фазы в жидкость и его саморазложения. Интенсивность непрямого окисления прямо пропорциональна количеству разложившегося озона и обратно пропорциональна концентрации присутствующих в воде загрязнителей.
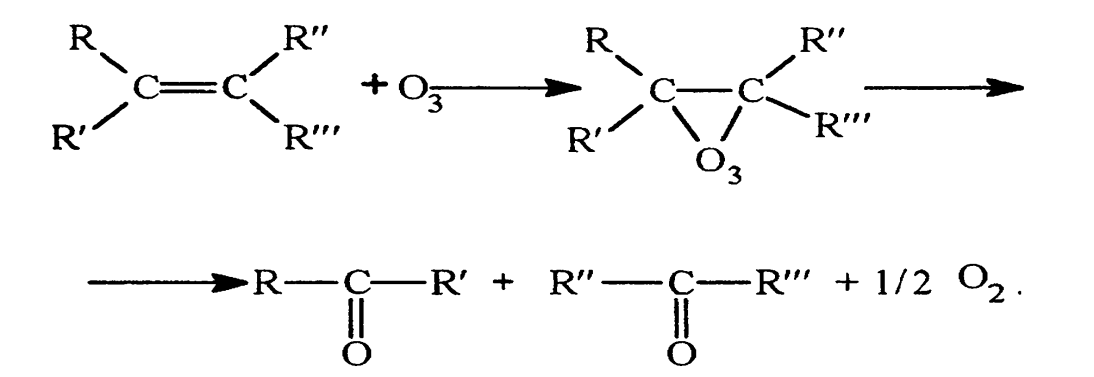
Озонолиз представляет собой процесс фиксации озона на двойной или тройной углеродной связи с последующим ее разрывом и образованием озонидов, которые, как и озон, являются нестойкими соединениями и быстро разлагаются:
Катализ — каталитическое воздействие озонирования заключается в усилении им окисляющей способности кислорода, который и присутствует в озонированном воздухе. Озон получают из кислорода воздуха под действием электрического разряда в генераторах. Перед подачей воздуха или чистого кислорода в генератор его предварительно осушают, так как с увеличением влажности воздуха выход озона уменьшается.
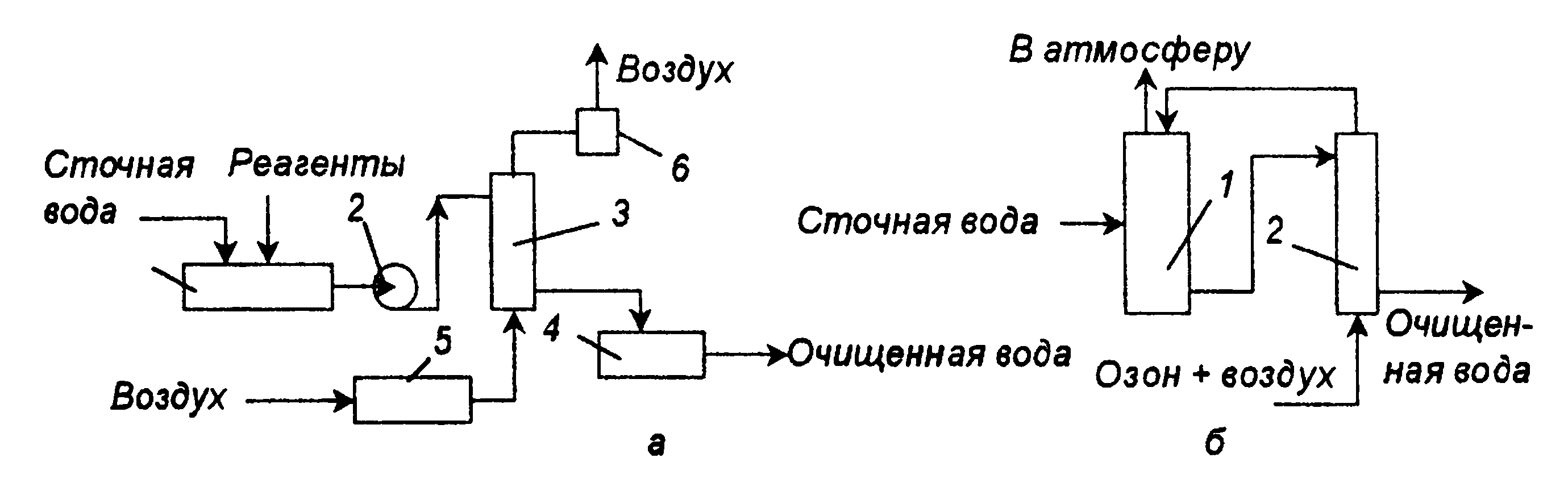
Рис. П-61. Схемы установок для очистки сточных вод озоном: a — одноступенчатая: 1 — смеситель, 2 — насос, 3 — реактор, 4 — сборник, 5 — озонаторная установка, 6 — блок очистки отходящих газов; б — двухступенчатая с предварительным озонированием: 1,2 — реакторы.
51. Очистка сточных вод от соединений хрома (6+) восстановлением с последующим осаждением. Применяемые восстановители и осадители, уравнения и условия реакций.
Метод основан на восстановлении его до трехвалентного с последующим осаждением в виде гидроксида в щелочной среде. В качестве восстановителей мопт быть использованы активный уголь, сульфат железа (закисного), бисульфат натрия, водород, диоксид серы, отходы органических веществ (например, газетная бумага), пиритный огарок и др. На практике для восстановления наиболее часто используют растворы гидросульфита (бисульфита) натрия: 4Н2СrO4 + 6NaHSO3 + 3H2SO4-+ 2Cr2(SO4) + 3Na2SO4 + 10H2O
Реакция протекает быстро при рН = 3-4 и избытке серной кислоты. Для осаждения трехвалентного хрома применяют щелочные реагенты Са(ОН)2, NaOH и др. (оптимальное значение рН для осаждения 8-9,5):
Сг3+ + 3ОН = Сr(ОН)3
Очистку проводят на установках периодического или непрерывного действия. Хорошие результаты получаются при использовании в качестве восстановителя сульфата железа FeSO4. Процесс м проводить как в кислой, так и в щелочной среде:
2CrO3 + 6FeSO4 + 6H2SO4 = 3Fe2(SO4) + Cr2(SO4) + 6Н2O
2CrO3 + 6FeSO4 + 6Са(ОН)2+ 6H20= 2Cr(OH)3+6Fe(OH)3+6CaSO4.
Расход FeSO4 зависит от рН среды и концентрации хрома. Наиболее благоприятные условия проведения процесса: температура 20 °С, рН = 7 и расход FeSO4 в 1,3 раза больше стехиометрического. Восстановление диоксидом серы происходит по схеме:
SO2 + H2O=H2SO3, 2CrO3 + 3H2SO3=Cr2(SO4)3 + 3H2O.
В присутствии соды в сточных водах хром полностью удаляется из них:
6Na2CrO4 + SO2 + Na2CO3+nH2O=Cr2O3*nH2O+ 3Na2SO4 + CO2.
Процесс восстановления проводят при 90°С. После отделения осадка фильтрованием в сточных водах остается только сульфат натрия. Осадок прокаливают при высокой температуре с целью получения стандартного оксида хрома.
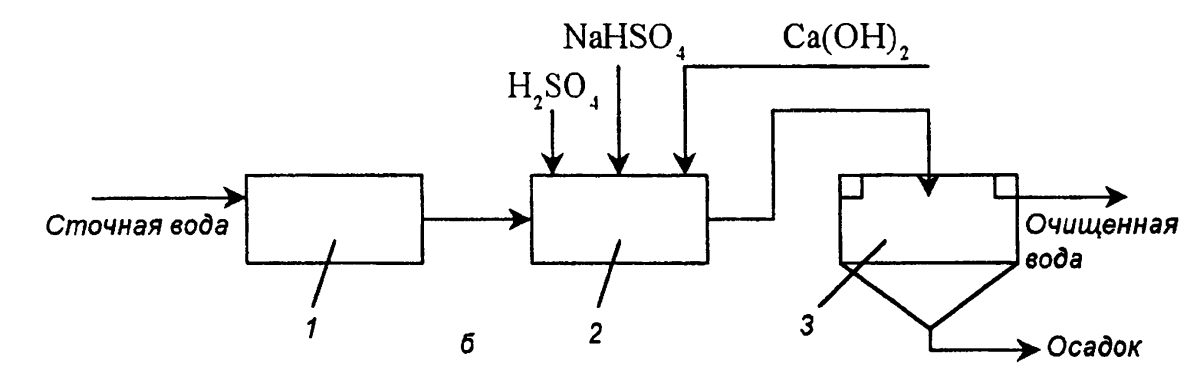
Схемы непрерывного действия- 1 — усреднитель (10-20 мин), 2 — смеситель (pH д.б. 2,5-3, потом ↑ доб. Са(ОН)2 до 8-9, продолжит-ть обезвреживания 30 мин), 3 - емкость для нейтрализации и отстаивания. Осадок выпадает медленно, трудно уплотняется и обезвреж-ся. Для ускорения осаждения доб. полиакриламид.