- •Задание на курсовое проектирование
- •Расчет константы равновесия для основного процесса
- •Анализ процессов сублимации исходных компонентов
- •Построение линий трехфазного равновесия (p-t диаграмм)
- •Расчет парциальных давлений паров компонентов, обеспечивающих протекание основного процесса в прямом направлении
- •Оценка возможности окисления кадмия и необходимой степени откачки реактора.
- •8. Выводы
- •9. Список использованной литературы
Оценка возможности окисления кадмия и необходимой степени откачки реактора.
В атмосфере реактора неизбежно будет присутствовать кислород, который будет окислять вещества, участвующие в реакции. Рассмотрим окисление кадмия:
Cd(тв) + 0.5 O2(г) = CdO(тв)
Константа равновесия для этой реакции:
КР = ΔGT/RT = (1/РО21/2)равн
ΔGT = -RTln(Kp)реал + RTln(Kp)равн
ΔGT = -RTln(1/РО21/2)равн + RTln(1/РО21/2)реал
ΔGT = 0,5RTln(PO2)равн – 0.5RTln(PO2)реальн
Поскольку процесс окисления нежелателен, будем искать условия при которых процесс будет термодинамически невыгоден, то есть изменение свободной энергии Гиббса положительно.
ΔGT > 0
Выполняется, если (PO2)равн > (PO2)реальн
Расчет:
На основании закона Гесса рассчитаем стандартную энтальпию процесса ΔHo298:
ΔHo298=Σνi ΔHof,298(кон)- Σνi ΔHof,298(исх) , где νi-число молей вещества.
ΔHo298= ΔHof,298 (CdОтв)-( ΔHof,298 (Cdтв)+ ΔHof,298 (О2г)) = -256,1 кДж
Расчитаем стандартную энтропию процесса ΔSo298:
ΔSo298 = Σνi ΔSo298(кон)- Σνi ΔSof,298(исх)
ΔSo298 = ΔSo298 (CdОтв)-( ΔSo298 (Cdтв)+ ΔSo298 (О2г)) = 54,8-51,76-0,5∙205,03 = -99,475 Дж/К
Свободная энергия Гиббса:
ΔGo298 = ΔHo298 – 298ΔSo298
ΔGo298 = -256100 + 298∙99,475 = -226,456 кДж
lg(Kp) = - ΔGo298/(298Rln(10)) = 226456,4/(298∙8,31∙ln10) = 39,715
ΔGo800 = ΔHo298 – 800ΔSo298 + 298∫800ΔCpodT – 800298∫800(ΔCpo/T)dT = -256100 + 800∙99,475 + 2,805∙(800-298) - 800∙2,805∙ln(800/298) = -177,328 кДж
lg(Kp) = - ΔGo800/(800Rln(10)) = 11,584
T,K |
∆G0,кДж/моль |
lgKp |
298 |
-226,456 |
39,715 |
800 |
-177,328 |
11,584 |
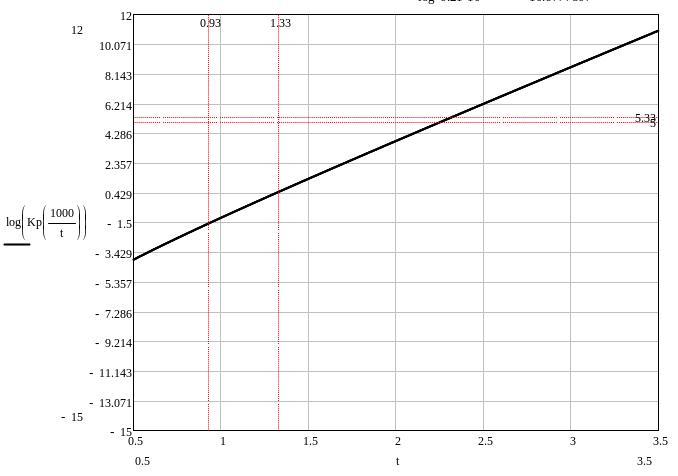
Окисления кадмия избежать невозможно, рекомендуется откачать воздух до минимально возможного, т.к. малое количество кислорода не сможет сильно окислить кадмий.
8. Выводы
1. Процесс получения сульфида кадмия n-типа электропроводности путем выращивания эпитаксиальных слоев из газообразных компонентов возможен с точки зрения термодинамики при предлагаемых условиях проведения процесса:
TCd = 847 К
TTe2 = 625К
TCdTe = 1200 К
В качестве рекомендаций можно предложить откачать ампулу реактора до максимального высокого вакуума, не использовать нижние слои полупроводникового соединения.
Приведем принципиальную схему реактора и приблизительное распределение температур:
TCd
= 847К
TTe2
= 625К
TCdTe
= 1200К
PCd
= 4∙10-2атм
PTe2
= 0.9
атм
CdTe
Te2
Cd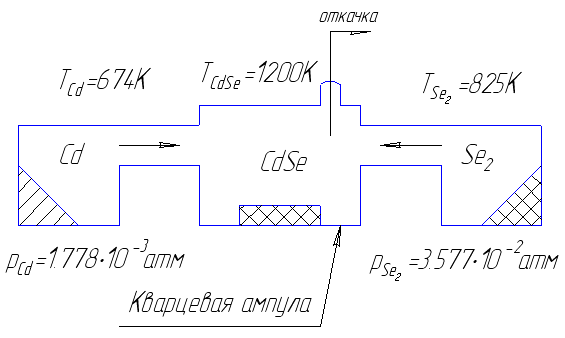
Рис. 4.1. Принциапиальная схема реактора с тремя температурно независимыми зонами: A – для подогрева и испарения Cd, B – для подогрева и испарения Te2, AB – для синтеза CdTe.
TA
TB
TAB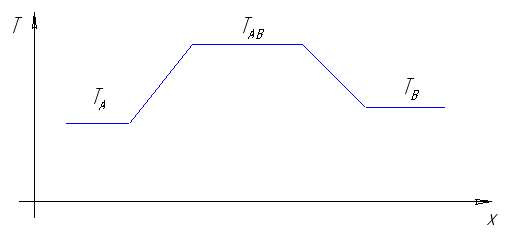

9. Список использованной литературы
Горелик С.С., Дашевский М.Я., «Материаловедение полупроводников и диэлектриков», Москва: Издательство МИСИС, 2003
Луцкая О.Ф., Чеснокова Д.Б., Максимов А.И., «Химические и фазовые равновесия в технологии материалов электронной техники», СПб.: Издательство СПбГЭТУ "ЛЭТИ", 2005
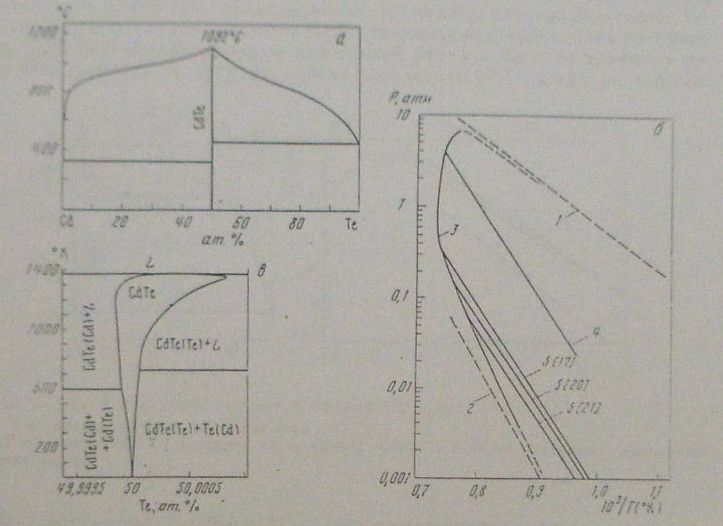
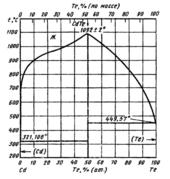 Температура плавления соединения CdTe
соответствует 1092 °С. Максимум на кривой
ликвидус смещен в сторону избытка
теллура относительно стехиометрического
состава на 4- 10 4 % (ат.) . Соединение CdTe
имеет узкую область гомогенности: при
727 °С она простирается на 2- 10-4 % (ат.) как
в сторону избытка Cd, так и в сторону
избытка Те .
Температура плавления соединения CdTe
соответствует 1092 °С. Максимум на кривой
ликвидус смещен в сторону избытка
теллура относительно стехиометрического
состава на 4- 10 4 % (ат.) . Соединение CdTe
имеет узкую область гомогенности: при
727 °С она простирается на 2- 10-4 % (ат.) как
в сторону избытка Cd, так и в сторону
избытка Те .
Вырожденные эвтектики со стороны Cd и Те имеют температуру плавления чистых металлов. Результаты термодинамических расчетов фазовых равновесий в системе Cd—Те находятся в хорошем согласии с экспериментальными данными.
Температура плавления CdTe понижается с увеличением давления . Соединение CdTe может существовать в двух модификациях: в структуре типа вюртцита и сфалерита.