
- •Задание на курсовое проектирование
- •Расчет константы равновесия для основного процесса
- •Анализ процессов сублимации исходных компонентов
- •Построение линий трехфазного равновесия (p-t диаграмм)
- •Расчет парциальных давлений паров компонентов, обеспечивающих протекание основного процесса в прямом направлении
- •Оценка возможности окисления кадмия и необходимой степени откачки реактора.
- •8. Выводы
- •9. Список использованной литературы
Санкт-Петербургский государственный
электротехнический университет "ЛЭТИ" им. В. И. Ульянова (Ленина)
кафедра МЭ
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
к курсовой работе по физико-химическим основам технологии материалов и изделий электронной техники на тему
" Термодинамический анализ физико-химического процесса "
Студент: Каблуков Д. Е.
Группа: 8207
Преподаватель: Мараева Е. В.
Санкт-Петербург
2011 год
Задание на курсовое проектирование
Провести термодинамический анализ процесса выращивания монокристаллов (или эпитаксиальных слоев) соединения CdTe n-типа проводимости из газообразных компонентов:
![]()
Считать, что основной процесс проводится в условиях замкнутого или квазизамкнутого объема. Парциальные давления пара исходных компонентов (pCd и pTe2) в системе необходимо задавать и поддерживать постоянными в течение всего процесса синтеза путем сублимации (или испарения) конденсированных фаз компонентов Cd и Te в независимых дополнительных температурных зонах реактора с температурами TA и TB соответственно.
Расчет константы равновесия для основного процесса
Основной процесс получения бинарного полупроводникового соединения типа AIIBVI CdTe газофазным методом описывается уравнением:
![]()
Уравнение изотермы химической реакции:
ΔGT = ΔGoТ+ RTln(Πi piνi)
где ΔGoТ=-RTln(Kp) – изменение свободной энергии Гиббса при стандартных условиях.
Kp= (PСdPte20.5)0.5 -константа равновесия основного процесса.
ΔGT = -RTln(Kp) + RTln(Πi piνi)
ΔGT = RTln(PСdPte20.5)равн - RTln(PСdPte20.5)реальн
Расчитаем константу равновесия основного процесса основного процесса, для этого необходимо знать изменение свободной энергии Гиббса
![]()
ΔGo298 = ΔHo298 – 298ΔSo298
На основании закона Гесса расчитае стандартную энтальпию процесса ΔHo298:
ΔHo298=Σνi ΔHof,298(кон)- Σνi ΔHof,298(исх),
где νi-число молей вещества.
ΔHo298= ΔHof,298 (Cdteтв)-( ΔHof,298 (Cdг)+ ΔHof,298 (teг))=-70,82 кДж
Расчитаем стандартную энтропию процесса ΔSo298:
ΔSo298=Σνi ΔSof,298(кон)- Σνi ΔSof,298(исх)= ΔSof,298 (Cdteтв)-( ΔSof,298 (Cdг)+ ΔSof,298 (teг)) =-49,4 Дж/К
Изменение свободной энергии для стандартных условий процесса:
ΔGo298 = ΔHo298 – 298ΔSo298=-270148Дж.
Константу равновесия получаем равную:
lg(Kp) = - ΔGo298/(298Rln(10))=-47,45
Построим график зависимости lgPCdPTe21/2 от обратной температуры:
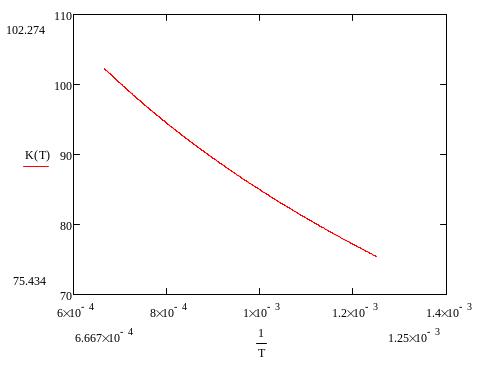
.
Анализ процессов сублимации исходных компонентов
Анализ процесса сублимации Cd
Сублимация Cd рассматривается при температуре от 298 К до температуры плавления кадмия 594 К. Считаем, что пар Cd одноатомный.
![]()
Аналогично, используем уравнение изотермы химической реакции для стандартных условий, с учетом того, что для этого процесса РCd = Kp
![]()
Из справочных данных получаем
![]()
![]()
ΔGo298 = ΔHo298 – 298ΔSo298 = 111800 - 298∙115,84 = 77279,68 Дж
lg(Kp) = - ΔGo298/(298Rln(10))
Испарение Cd рассматривается при температуре от температуры плавления кадмия 594 К до температуры кипения кадмия 1040 К. Считаем, что пар Cd одноатомный.
![]()
Аналогично, используем уравнение изотермы химической реакции для стандартных условий, с учетом того, что для этого процесса РCd = Kp
Из справочных данных
Поскольку имеет место фазовый переход, то зависимость изменения энтальпии реакции от температуры приобретает более сложный вид.
Фазовый переход происходит для исходного компонента, поэтому энтальпия фазового перехода принимается отрицательной dHfpCd < 0
![]()
ΔGo594 = ΔHo298 – 594ΔSo298 + 298∫594ΔCpodT – 594298∫594(ΔCpo/T)dT = 111800 - 594∙115,84 -21,38∙(594-298) + 594∙21,38∙ln594/298 = 45.422 кДж
![]()
![]()
ΔGo900 = ΔHo298 – ΔHпл – 900(ΔSo298 + ΔSпл)+ 298∫594ΔCpodT – 900298∫594(ΔCpo/T)dT +
+ 594∫900ΔCpo’dT – 900594∫900(ΔCpo’/T)dT
T,K (расчет) |
lnKp (расчет) |
T,K (эксперимент) |
lnKp (эксперимент) |
298 |
-13,55 |
293 |
-13,88 |
594 |
-3,996 |
593 |
-3,88 |
900 |
-0,98 |
885 |
-0,88 |
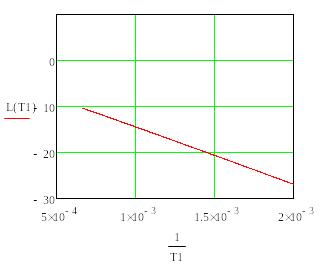
Рис. 2.1. Зависимость десятичного логарифма константы равновесия
процесса испарения и сублимации кадмия от обратной температуры
Анализ процесса сублимации Te
![]() .
.
Найдем условие протекания процесса сублимации:
GT=
– RTln(Kp) +
RTln(Пi
pivi),
где Кр =
![]() – константа равновесия процесса
сублимации теллура.
– константа равновесия процесса
сублимации теллура.
GT=
RTln![]() реал
– RTln
равн.
реал
– RTln
равн.
Процесс может протекать лишь при условии, что GT < 0, а это возможно лишь при условии: равн > реал.
Рассчитаем константу равновесия аналогично основному процессу, но с учетом фазового перехода.
![]()
При Т=298 К:
![]()
![]()
![]()
При Т=723 К:
![]() ,
где
,
где
![]() .
.
![]() ,
где
,
где
![]() .
.
![]() .
.
При Т=1260 К:
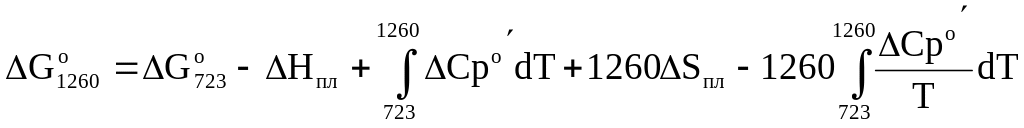
![]() ,
где
,
где
![]() .
.
Т, К |
|
|
|
298 |
58,97 |
-10,34 |
-20,68 |
723 |
24,71 |
-1,79 |
-3,58 |
1260 |
11,52 |
-0,48 |
-0,96 |
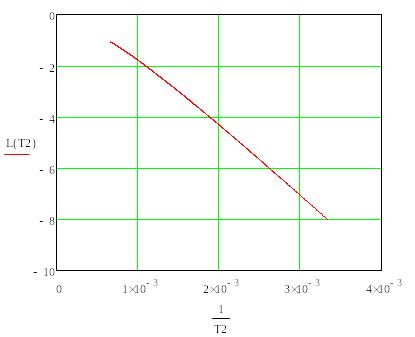
Рис. 2.2. График зависимости десятичного логарифма равновесного давления пара теллура от обратной температуры для процесса сублимации.
