
- •Понятие «фермент». Свойства ферментов. Отличие ферментов от неорганических катализаторов.
- •1) Специфичность (избирательность) действия.
- •Какие вещества называются ферментами? Их химическая природа и строение? Свойства ферментов.
- •1) Специфичность (избирательность) действия.
- •Структура и свойства ферментов. Чем обусловлено разнообразие ферментов? Охарактеризуйте специфичность действия ферментов, приведите примеры.
- •1) Специфичность (избирательность) действия.
- •Химическая природа ферментов. Строение ферментов. Активные центры ферментов. Множественные формы ферментов.
- •Строение ферментов
- •Активный центр ферментов
- •Строение ферментов. Общая характеристика небелковых частей ферментов, их структура, связь с витаминами; примеры.
- •Структура ферментов. Понятие простых и сложных ферментов. Приведите примеры. Апофермент, его структура и роль. Кофермент, его структура и роль.
- •8. Дайте характеристику изоферментов. Приведите примеры. Имеет ли изучение изоферментов для диагностики различных заболеваний? Ответ поясните. Изоферменты
- •9. Современные представления о механизме действия ферментов и регуляции их активности, привести примеры.
- •10. Современные представления о кинетике ферментативных реакций и факторы, которые на нее влияют.
- •11. Назовите факторы, которые влияют на скорость ферментативной реакции. Охарактеризуйте влияние этих факторов на скорость ферментативной реакции.
- •12. Регуляция активности ферментов; пути ее активации и инактивации. Влияние ионизирующего излучения и экологических факторов на ферменты.
- •13. Молекулярные механизмы регуляции активности ферментов.
- •Способы регуляции активности ферментов
- •2. Компартментализация
- •3. Генетическая регуляция
- •4. Ограниченный (частичный) протеолиз проферментов
- •5. Аллостерическая регуляция
- •Общий принцип аллостерической регуляции
- •Регуляция фосфофруктокиназы конечным продуктом
- •6. Белок-белковое взаимодействие
- •Принципиальная схема активации аденилатциклазы
- •Активация протеинкиназы а при помощи цАмф
- •7. Ковалентная (химическая) модификация
- •Изменение активности фермента при фосфорилировании-дефосфорилировании
- •14. Сущность биологического катализа. Роль белков в биологическом катализе.
- •Сущность явления катализа
- •15. Общие свойства ферментов. Международная классификация и номенклатура ферментов.
- •1) Специфичность (избирательность) действия.
- •16. Понятие «фермент». Классификация и номенклатура ферментов. Приведите примеры.
- •17. Классификация ферментов по типу катализируемой химической реакции (6 классов ферментов). Охарактеризуйте эти классы, приведите примеры.
- •18. Что такое «ингибиторы» и «активаторы» ферментов. Виды ингибирования.
- •19. Ингибирование работы ферментов. Применение ингибирования в медицине.
- •20. Применение ферментов в медицине. Понятие об энзимопатиях. Примеры.
- •21. Понятие метаболизма. Стадии метаболизма. Цикл трикарбоновых кислот (цикл Кребса), его роль в обмене углеводов, липидов, аминокислот.
- •I этап катаболизма происходит в желудочно-кишечном тракте и сводится к реакциям гидролиза пищевых веществ. Химическая энергия рассеивается в виде тепла.
- •22. Понятие «метаболические пути», их классификация. Современная теория тканевого дыхания. Дыхательная цепь, ее надмолекулярная организация.
- •23. Макроэргические соединения, их химическое строение. Роль в организме атф. Образование атф в организме (окислительное и субстратное фосфорилирование).
Принципиальная схема активации аденилатциклазы
Другим примером белок-белкового взаимодействия может быть регуляция активности протеинкиназы А. Протеинкиназа А является тетрамерным ферментом, состоящим из 2 каталитических (С) и 2 регуляторных (R) субъединиц. Активатором для протеинкиназы А является цАМФ. Присоединение цАМФ к регуляторным субъединицам фермента вызывает их отхождение от каталитических субъединиц. Каталитические субъединицы при этом активируются.
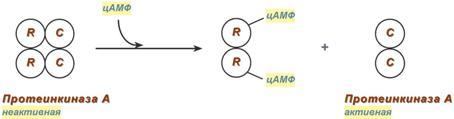
Активация протеинкиназы а при помощи цАмф
7. Ковалентная (химическая) модификация
Ковалентная модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы.
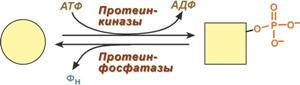
Изменение активности фермента при фосфорилировании-дефосфорилировании
Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии. Например, в мышцах ферменты гликогенфосфорилазаи гликогенсинтаза
-
при нагрузке фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена и сжигание глюкозы, а гликогенсинтаза при этом неактивна.
-
во время отдыха при синтезе гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза – неактивной.
14. Сущность биологического катализа. Роль белков в биологическом катализе.
Катализаторами называют вещества, изменяющие скорость химических реакций. Различают два вида катализа – гомогенный (однородный) и гетерогенный (неоднородный) катализ.
При гомогенном катализе реагирующие вещества и катализатор образуют однофазную систему – газовую или жидкую, между катализатором и реагирующими веществами отсутствует поверхность раздела. Например, каталитическое разложение пероксида водорода в присутствии раствора солей (жидкая фаза). Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора.
При гетерогенном катализе реагирующие вещества и катализатор образуют систему из разных фаз. При этом между катализатором и реагирующими веществами существует поверхность раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – газы или жидкости. Например, окисление аммиака (газообразная фаза) в присутствии платины (твердая фаза) или разложение пероксида водорода (жидкая фаза) в присутствии угля или оксида марганца (IV) (твердая фаза). Все реакции при гетерогенном катализе протекают на поверхности катализатора. Поэтому активность твердого катализатора зависит и от свойств его поверхности (размера, химического состава, строения и состояния). Понятия гомо- и гетерогенного катализа обычно применяют для небиологических катализаторов.
Сущность явления катализа
Фермент, выполняя функцию катализатора химической реакции, подчиняется общим законам катализа и обладает всеми свойствами, характерными для небиологических катализаторов, однако имеет и отличительные, уникальные свойства, которые выделяют их на фоне обычных органических катализаторов гомогенного типа. Обеспечиваются эти свойства особенностями строения ферментов.
Сходство ферментов с небиологическими катализаторами заключается в том, что ферменты:
1) катализируют только энергетически возможные реакции, то есть те реакции которые могут протекать и без них;
2) не изменяют направление реакции;
3) не сдвигают равновесие обратимой реакции, а лишь ускоряют его наступление;
4) не расходуются в процессе реакции и выходят из реакции в первоначальном виде.
Oтличие ферментов от небиологических катализаторов заключается в том, что:
1) скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами (эффективность действия ферментов). Для большинства ферментов характерно то, что 1 молекула фермента может превратить от 1000 до 1 млн молекул субстрата за 1 минуту. Эта скорость недостижима для небиологических катализаторов.
2) ферменты обладают высокой специфичностью действия;
3) ферменты катализируют реакции в очень мягких условиях (обычное давление, нейтральная рН, невысокая t);
4) активность ферментов в клетках строго регулируется как на генетическом уровне, так и посредством определённых низкомолекулярных соединений (субстратов и продуктов реакции, катализируемых этими же ферментами);
