- •24. Макроэргические соединения; их химическое строение, роль в организме атф. Цтк. Энергетический эффект цикла трикарбоновых кислот.
- •Атф и адениловая система клетки
- •26. Анаболизм и катаболизм, амфиболические пути. Охарактеризуйте цитратный цикл.
- •27.Общие принцины биологической термодинамики. Современные представления о механизме окислительного фосфорилирования.
- •28. Общие принципы биологической термодинамики. Окислительное и субстратное фосфорилирование. Механизм сопряжения окислительного фосфорилирования и тканевого дыхания.
- •29. Образование в процессах метаболизма воды и углекислоты - конечных продуктов обмена веществ (цтк и тканевое дыхание).
- •30. Современные представления о механизме тканевого дыхания. Характеристика ферментов и коферментов тканевого дыхания.
- •31. Современная теория тканевого дыхания. Дыхательная цепь, ее надмолекулярная организация. Виды дыхательных цепей.
- •42.Окислительное декарбоксилирование а-кетокислот. Механизм и регуляция окислительного декарбоксилирование пировиноградной кислоты.
- •43. Окислительное декарбоксилирование пировиноградной кислоты. Его биологическое значение.
- •44. Какое участие кислорода в биологическом окислении? в каких случаях при тканевом дыхании возможно образование перекиси водорода н2о2? Каким образом организм ее обезвреживает?
- •45. Обмен пировиноградной кислоты в тканях.
42.Окислительное декарбоксилирование а-кетокислот. Механизм и регуляция окислительного декарбоксилирование пировиноградной кислоты.
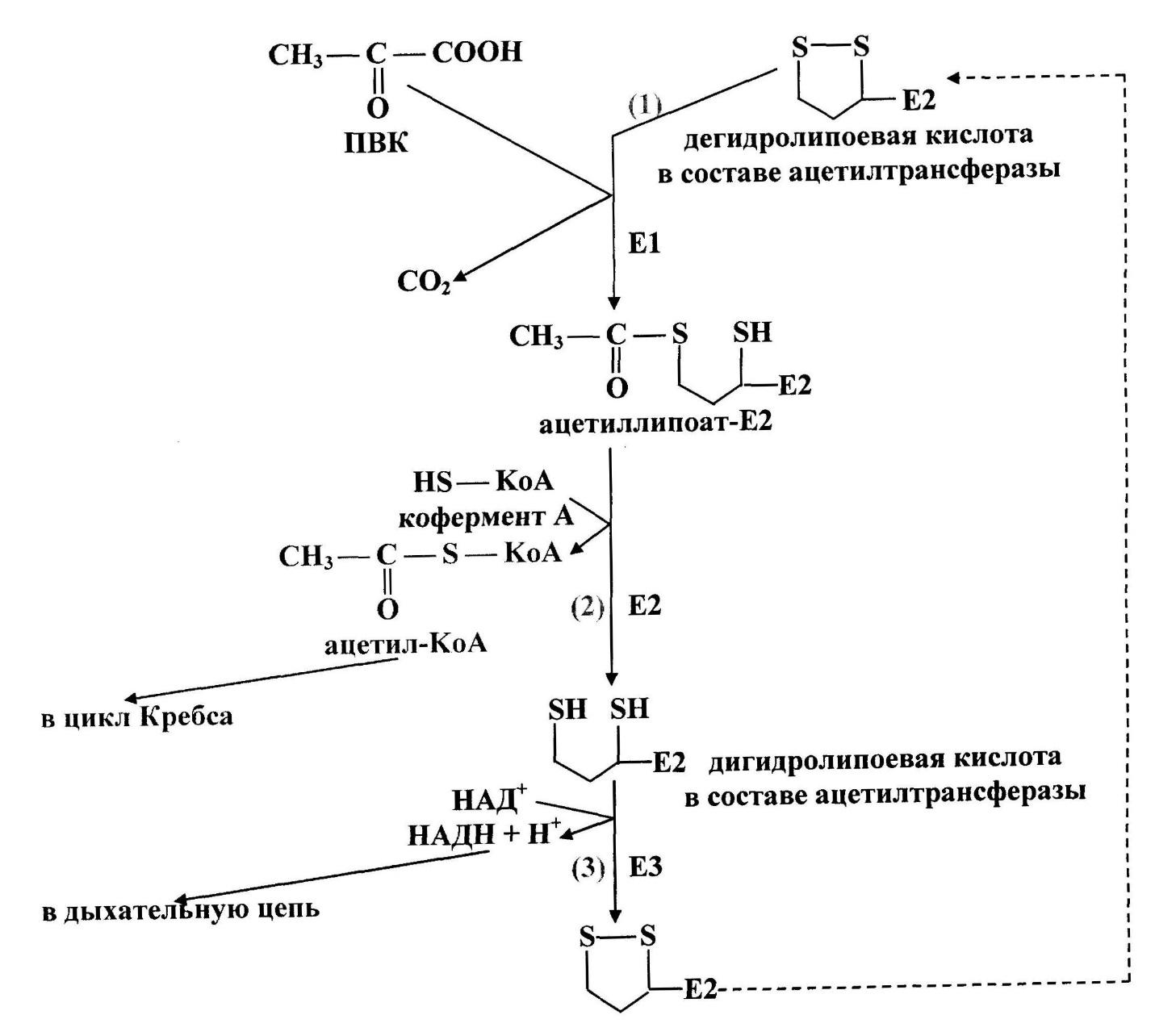
Окислительное декарбоксилирование а-кетокислот в карбо-новые кислоты с уменьшенной на один атом цепью углеродных атомов осуществляется при участии системы ферментов. Через ряд каталитических превращений пировиноградная кислота, являющаяся одним из продуктов углеводного обмена ( в частности гликолиза), в виде продукта ее декарбоксилирова-ния и дегидрирования - высоко макроэргического ацетил - КоА - вводится в цикл трикарбоновых кислот в звене превращений ща-велевоуксусной кислоты в лимонную кислоту и в конечном счете окисляется в двуокись углерода и воду. Первичное расщепление пировиноградной кислоты с отделением двуокиси углерода осуществляет ТДФ. В последующих превращениях образовавшегося ацильного остатка окислительным агентом служит а-липоевая кислота, которая сама при этом подвергается восстановительному ацилированию при каталитическом действии пируватдегидрогеназы в 6-ацетилдигидролипоевую кислоту. Аминокислоты декарбоксилируют только а-кетокислоты. Триметилпировиноградная кислота не декарбоксилируется. Установлено, что а-кетокислоты, воз-никшие в процессе дезаминирования а-аминокислот, могут подвергаться в животных тканях д е к а р-боксилированию и одновременному окислению в жирную кислоту. Так же как а-кетокислоты, а, р-ненасыщенные кетоны не взаимодействуют с надкислотами, поскольку С С-связь в этом случае носит электрофильный, а не нуклеофильный характер. Тидрокси - и а-кетокислоты не расщепляются под действием Н1О4, но эта реакция идет с тетраацетатом свинца, На02 в щелочной среде и другими реагентами. Такие реакции представляют собой окислительное декарбоксилирование. Окисление пирувата до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединенных структурно в мультиферментную систему, получившую название «пируватдегидрогеназный ком-плекс». На I стадии этого процесса пируват теряет свою карбоксильную группу в результате взаимодействия с тиа-минпирофосфатом (ТПФ) в составе активного центра фермента пируватдегидрогеназы (E1). На II стадии оксиэтильная группа комплекса E1–ТПФ–СНОН–СН3 окисляется с образованием ацетильной группы, которая одновременно переносится на амид липоевой кислоты (кофермент), связанной с ферментом дигидро-ли-поилацетилтрансферазой (Е2). Этот фермент катализирует III стадию – перенос ацетильной группы на коэнзим КоА (HS-KoA) с образованием конечного продукта ацетил-КоА, который является высокоэнергетическим (макроэргическим) соединением. На IV стадии регенерируется окисленная форма липоамида из восста-новленного комплекса дигидролипоамид–Е2. При участии фер-мента дигидролипоилдегидрогеназы (Е3) осуществляется перенос атомов водорода от восстановленных сульфгидрильных групп дигидролипоамида на ФАД, который выполняет роль простетиче-ской группы данного фермента и прочно с ним связан. На V стадии восстановленный ФАДН2 дигидро-липоилдегидрогеназы передает водород на кофермент НАД с образованием НАДН + Н+. Процесс окислительного декарбоксилирования пирувата происходит в матриксе митохондрий. В нем принимают участие (в составе сложного мультиферментного комплекса) 3 фермента (пируватдегидрогеназа, ди-гидролипоилацетилтрансфераза, дигидролипоилдегидрогеназа) и 5 кофер-ментов (ТПФ, амид липоевой кислоты, коэнзим А, ФАД и НАД), из которых три относительно прочно связаны с ферментами (ТПФ-E1, ли-по-амид-Е2 и ФАД-Е3), а два – легко диссоциируют (HS-KoA и НАД).
ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПВК
Окислительное декарбоксилирование пировиноградной кислоты - многостадийный процесс, который катализирует пируватдегидрогеназный комплекс - митохондриальный мультиферментный комплекс, соединенный с внутренней мембраной со стороны матрикса. ПВК поступает к комплексу из матрикса, и туда же освобождаются продукты реакции.
Пируватдегидрогеназный комплекс включает три фермента (пируватдегидрогеназа (Е1), ацетилтрансфераза (Е2), дегидрогеназа дигидролипоевой кислоты (Е3)) и пять коферментов (НАД+, ФАД, тиаминпирофосфат, липоевая кислота, кофермент А (рис. 36)).
Тиаминпирофосфат связан с пируватдегидрогеназой (Е1), липоевая кислота - с ацетилтрансферазой (Е2), ФАД - с дегидрогеназой дигидролипоевой кислоты (Е3). Кофермент А и НАД+ находятся в свободно растворенном состоянии.
В состав пируватдегидрогеназного комплекса входит примерно по три десятка молекул Е1 и Е2 и 10 молекул Е3. Комплекс работает как конвейер: промежуточные продукты не освобождаются в раствор, а передаются от фермента к ферменту.
Первую реакцию (рис. 37) катализирует Е1, субстратами являются ПВК и дегидролипоевая кислота, являющаяся простетической группой Е2. От ПВК отщепляется карбоксильная группа и образуется СО2, а ацетильный остаток соединяется с атомом серы липоевой кислоты в составе ацетилтрансферазы. Образуется ацетиллипоат-Е2.
Во второй реакцииацетилтрансфераза (Е2) катализирует перенос ацетильного остатка, соединенного с его простетической группой, на коэнзим А. Продукты этой реакции - дигидролипоевая кислота в составе Е2 и ацетил-KоА.
В третьей реакциипроисходит дегидрирование дигидролипоевой кислоты в составе ацетилтрансферазы при воздействии фермента Е3 (дегидрогеназа дигидролипоевой кислоты), содержащего ФАД. ФАД передает водород на НАД+. Образуются НАДН+Н+ и дегидролипоевая кислота в составе Е2. Последний фермент снова вступает в окислительное декарбоксилирование ПВК.
Ацетил-KоА (продукт второй реакции) затем окисляется в цикле Кребса. Водород с НАДН (продукт третьей реакции) поступает в дыхательную цепь, где образуется АТФ.
Энергетический выход окислительного декарбоксилирования пирувата – 3 АТФ.
Суммарное уравнение процесса:
СH3-CО-COOH + HS-KoA + НАД+ ® СH3-CО-S-KoA + НАДН + Н+ + СО2.
Схема окислительного декарбоксилирования пирувата