
- •Тема: Белки I. Механизмы переваривание и всасывания белков
- •Роль белка в питании. Показатели качества пищевого белка
- •Количество белка в некоторых пищевых продуктах
- •3. Азотистый баланс. Принципы нормирования белка в питании. Белковая недостаточность
- •Нормы белка в питании
- •Белковая недостаточность
- •Переваривание белков в жкт
- •Переваривание белков в желудке
- •Состав желудочного сока
- •Нарушения переваривания белков в желудке
- •Защита клеток от действия протеаз
- •Регуляция желудочно-кишечной секреции
- •Нарушение переваривания белков и транспорта аминокислот
- •4. «Гниение» белков в кишечнике. Роль удф-глюкуроновой кислоты и фафс в процессах обезвреживания и выведения продуктов «гниения» (фенол, индол, скатол, индоксил и др.). Гниение
- •Лекция № 18 Тема: Белки II. Общие пути обмена аминокислот. Биосинтез мочевины.
- •Пути образования пула аминокислот в крови и его использование в организме
- •Общие реакции обмена аминокислот
- •Трансаминирование (переаминирование) аминокислот
- •Дезаминирование аминокислот
- •Прямое дезаминирование ак
- •2. Оксидаза l-аминокислот
- •3. Оксидаза d-аминокислот
- •Пути обмена безазотистого остатка аминокислот
- •Связывание (обезвреживание) аммиака
- •Орнитиновый цикл
- •Гипераммониемия
- •Обмен аминокислот и аммиака между тканями
- •Декарбоксилирование аминокислот и их производных
- •Лекция № 19 Тема: Белки III. Специфические пути обмена аминокислот фолиевая кислота
- •Кобаламин (в12)
- •Обмен серина и глицина
- •Путь образования оксалатов из глицина
- •Метионин
- •Цистеин
- •Фенилаланин
- •Тирозин
- •1. Обмен тирозина в надпочечниках и нервной ткани
- •2. Обмен тирозина в меланоцитах
- •3. Превращение тирозина в щитовидной железе
- •5. Катаболизм тирозина в печени
- •Триптофан
- •Глутамат
- •Глутамин
- •Аспартат
- •Аспарагин
Связывание (обезвреживание) аммиака
В связи с токсичностью аммиака в тканях происходит его связывание с образованием нетоксичных соединений – АК и мочевины. Процесс образования и обезвреживания аммиака регулируют в основном ферменты глутаматдегидрогеназа и глутаминсинтетаза.
Обмен глутамата
В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию.

Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
Обмен глутамина
Основной реакцией связывания аммиака, протекающей во всех тканях организма (основные поставщики мышцы, мозг и печень), является синтез глутамина под действием глутаминсинтетазы:
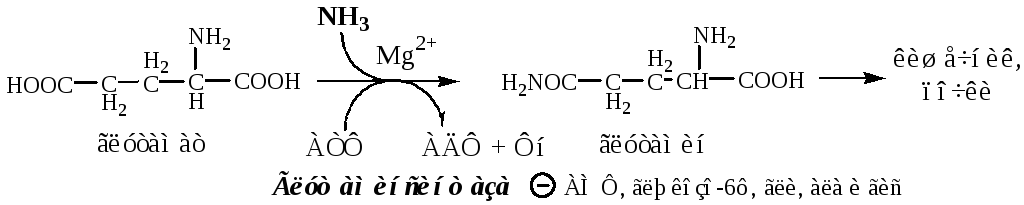
Глутаминсинтетаза находиться в митохондриях клеток, содержит кофактор — ионы Mg2+, является одним из основных регуляторных ферментов обмена АК. Она аллостерически ингибируется АМФ, глюкозо-6ф, гли, ала и гис.
Глутамин, путём облегчённой диффузии, легко проходит клеточные мембраны (для глутамата возможен только активный транспорт), поступает из тканей в кровь и транспортируется в кишечник и почки.
В почках происходит гидролиз глутамина под действием глутаминазы с образованием аммиака:

Аммиак с протонами и анионами образует соли аммония (0,5 г/сут), которые выделяются с мочой. Этот процесс используется для регуляции КОС и сохранения в организме важнейших катионов Na+ и К+. Глутаминаза почек значительно индуцируется при ацидозе, ингибируется при алкалозе.
В клетках кишечника также под действием глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:

Образовавшийся аммиак поступает через воротную вену в печень или удаляется из организма с фекалиями.
Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин — основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений.
Обмен аспарагина
Обезвреживание аммиака в тканях происходит незначительно при синтезе аспарагина под действием глутаминзависимой и аммиакзависимой аспарагинсинтетазы.

Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных.
Обмен аланина
Из мышц и кишечника избыток аминого азота выводится преимущественно в виде аланина.
В кишечнике:
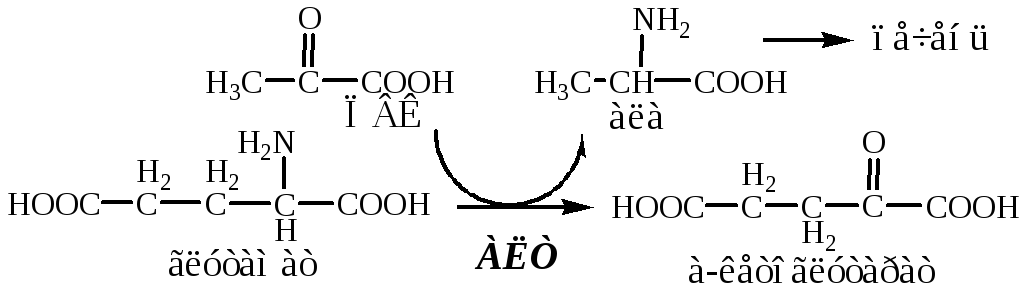
Глутамат подвергается трансаминированию с ПВК с образованием аланина и α-кетоглутарата. Аланин поступает из кишечника в кровь воротной вены и поглощается печенью.
В мышцах:
Образование аланина в мышцах, его перенос в печень связан с обратным переносом в мышцы синтезированной в печени глюкозы. Этот процесс называется глюкозо-аланиновый цикл:
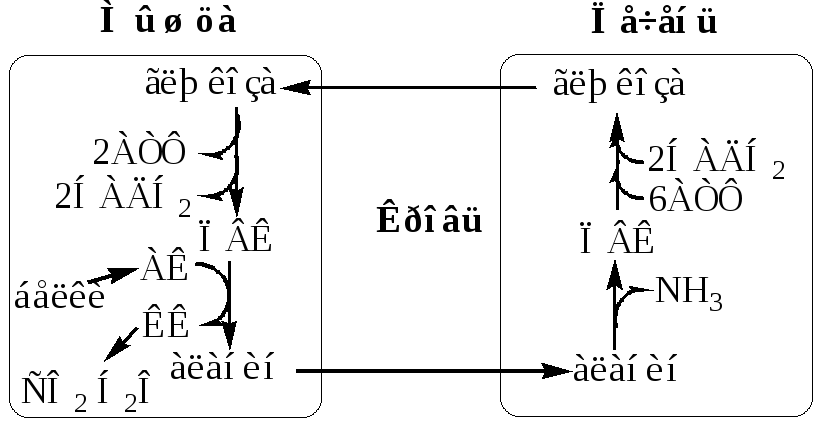
Он необходим, так как активность глу-ДГ в мышцах невелика и непрямое дезаминирование АК малоэффективно.
Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада АК. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак идет на синтез мочевины, а ПВК включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до ПВК.
