
Регуляция активности генов
Искусственно регулируя активность генов, кодирующих такие белки как актин-3, миостатин, инсулиноподобный фактор роста или PPAR-δ , можно придать организму исключительную физическую силу и выносливость практически без тренировок.
Понятно, что спортсмены и тренеры, нацеленные на победу любой ценой, проявляют к генной инженерии повышенный интерес. В частности, скандально известный немецкий тренер по легкой атлетике Томас Шпрингштайн, попавший под суд за то, что давал допинг своим несовершеннолетним подопечным, еще в 2006 году, как выяснилось в ходе процесса, экспериментировал с репоксигеном – препаратом на основе известного в генной инженерии аденовирусного вектора, несущего ген гормона эритропоэтина. Этот препарат разрабатывался для генной терапии анемии, то есть малокровия, и в экспериментах на обезьянах существенно увеличивал количество эритроцитов в крови. Однако введение в организм чужеродных генов чревато тяжелыми побочными реакциями.
Классические допинговые средства вроде анаболических стероидов тоже влияют на активность генов, но число этих генов измеряется тысячами. Новые научные исследования позволили синтезировать вещества, действующие гораздо более избирательно и прицельно. А обнаружить их крайне сложно. В частности, особое внимание экспертов привлекло к себе вещество, получившее техническое обозначение GW1516 – субстанция, разработанная для лечения ожирения, которая является модулятором активности (то есть экспрессии) гена PPAR-δ. Этот ген играет ключевую роль в расщеплении жиров и в трансформации мышечных волокон второго типа («быстрых», но маловыносливых) в мышечные волокна первого типа («медленные», но очень выносливые). Обычно такая трансформация достигается регулярными изнурительными тренировками, но опыты на мышах-марафонцах показали, что тренировки с успехом может заменить вещество GW1516. Сегодня это вещество входит в перечень запрещенных препаратов, составляемый Международным антидопинговым агентством.
Методику, позволяющую обнаружить его в крови спортсменов, разработали кельнские ученые. Сначала пробу крови помещают в центрифугу, что позволяет отделить плазму от клеточных компонентов. Затем мешающие анализу примеси удаляют методом хроматографии. И, наконец, масс-спектрометрия позволяет обнаружить в крови сам допинг, если он там есть. Метод вполне надежен, а вся необходимая для анализа аппаратура имеется в любой допинг-лаборатории. Теперь ученые хотят распространить методику и на мочу, поскольку чаще всего для допинг-анализа привозят именно мочу. Они считают, что вообще самый перспективный путь – искать не сам допинг, а вызываемые им специфические изменения метаболизма, следы его воздействия.[1]
Миостатин
Успехи в силовых видах спорта напрямую связаны с объемом мышечной ткани. До недавнего времени для ее быстрого наращивания применялись анаболические стероиды. Однако последние открытия генетиков позволяют покончить с этими вредными препаратами раз и навсегда.
Миостати́н (также известный как фактор роста и дифференцировки 8, GDF-8) – белок, который подавляет рост и дифференцировку мышечной ткани. Образуется в мышцах животных, затем выделяется в кровь, оказывая свое действие на мышцы за счет связывания с рецепторами ACVR2B (activin type II receptor). У человека миостатин закодирован в гене MSTN.
В 1997 году доктор Се-Джин Ли из Университета имени Джонса Хопкинса (США) в экспериментах на мышах доказал, что блокирование двух копий гена миостатина вызывает значительное повышение мышечной массы. Аналогичные генетические аномалии наблюдаются и у мясных пород коров (бельгийская голубая). В июне 2004 года доктор Маркус Шульке из университетской клиники Шарите (ФРГ) описал мальчика с аномально развитой мышечной массой, у которого также были повреждены оба гена миостатина.
На страницах популярного медицинского журнала The New England Journal of Medicine британские ученые предполагают, что активность гена миостатина можно блокировать и у взрослых людей. По их мнению, это позволит лечить мышечные дистрофии, кахексии и возрастные изменения мышечной ткани. Спортсмены же потирают руки в предвкушении нового способа увеличения физической силы.
В самый разгар афинской Олимпиады доктор Рональд Эванс из биологического института в Калифорнии на страницах журнала The Public Library of Science Biology объявил о создании мыши-марафонца. В организме грызуна был активирован ген «выключатель жира» (его Эванс открыл еще 10 лет назад), после чего резко увеличивалась выработка белка PPAR-δ. Как следствие у мышей-атлетов удвоилось количество «медленных и выносливых» мышечных волокон. Они получили возможность пробегать без остановки 1,8 км, в то время как рекорд обычных мышей – 900 м. Нетрудно представить, какие перспективы в этой связи открываются перед марафонцами, которые получат возможность нарастить нужные мышцы без строгих диет и изнурительных тренировок.
Не менее интересные перспективы открывают гены, отвечающие за функционирование сердечно-сосудистой системы. Санджай Раджагопалан из Мичиганского университета открыл ген роста клеток внутренней поверхности сосудов – vascular endothelial growth factor (VEGF). Первоначально его собирались использовать для лечения атеросклероза. Однако последующие эксперименты показали, что этот ген также весьма эффективен для улучшения кровоснабжения мышц.
Повысить выносливость спортсменов можно и с помощью эндотелиальной NO-синтетазы (ecNOS), отвечающей за тонус кровеносных сосудов, работу гладкомышечной мускулатуры сосудистой стенки и процессы тромбообразования. В этом направлении сейчас интенсивно работают ученые из университета Санкт-Петербурга.[13]
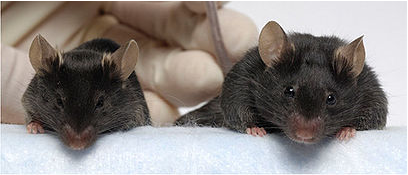
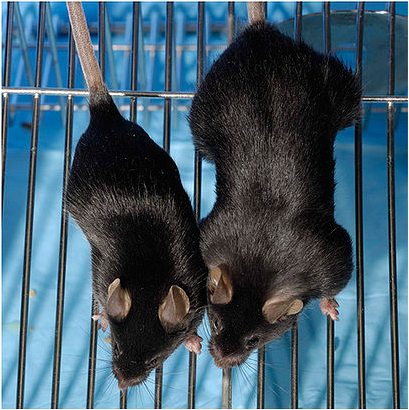
Рис.3 Мышь обычная (слева) и мышь с блокатором миостатина.
У мышей (Рис.3) в результате эксперимента произошло значительное (2–3-кратное) увеличение всех скелетных мышц. При этом увеличились как число мышечных волокон (гиперплазия), так и их толщина (гипертрофия). Полученные мыши были вполне жизнеспособны и давали потомство.
Объектом для обнаружения также были породы мясного скота с фенотипом так называемой удвоенной мышечной массы-породы бельгийская голубая и piedmontese (рис. 3).

Рис.3 Корова бельгийской голубой породы
Было обнаружено, что у коров породы бельгийская голубая имеются мутации в гене миостатина, которые тем или иным образом приводят к отсутствию функционально активного миостатина. В отличие от мышей с поврежденным геном миостатина у этих пород происходит только гиперплазия мышечной ткани без гипертрофии. Хотя применительно к этому мясному скоту используют термин "фенотип удвоенной мышечной массы", суммарное увеличение всех мышц составляет не более 40 % по сравнению с другими мясными породами, но и это, безусловно, неоценимо для мясного животноводства.
Способность миостатина ограничивать рост мышечной массы сразу привлекла к нему внимание как к потенциальной мишени для терапевтического вмешательства при дегенеративных заболеваниях, травмах и других патологиях мышечной системы, а также – для применения в спортивной медицине и спорте.
В результате экспериментов было доказано, что белок GDF-8 является отрицательным регулятором роста скелетных мышц. Поэтому он получил название миостатин, а животные с таким дефектом – миостатин-ноль мыши.[14]
Было установлено, что миостатин по своей структуре относится к белкам типа TGF-beta (Transforming Growth Factor-beta, трансформируюший фактор роста-бета), которые представляют собой секретируемые факторы, необходимые как в ходе эмбриогенеза, так и во взрослом состоянии для тканевого гомеостаза.
Миостатин имеет общие структурные свойства с другими белками семейства TGF-beta:
- гидрофобное ядро в районе N-концевой части молекулы, которое служит как секреторный сигнал;
- консервативный блок из четырех аминокислот в С-концевой половине молекулы, являющийся сигналом для процессинга (протеолитического расщепления в процессе образования активного белка из предшественника большей длины);
-девять остатков цистеина в С-концевой части молекулы, необходимых для образования функционально активной вторичной структуры. После процессинга С-концевой домен, который становится функционально активным миостатином, остается нековалентно связанным с N-концевой частью молекулы, которую в данном случае называют пропептидом;
- миостатин, как и другие белки типа TGF-beta, секретируется в виде неактивного комплекса с пропептидом.
Очевидно, что применение блокаторов миостатина повлечет за собой революционные изменения в медицине и спорте и, возможно, будет широко использоваться в терапевтических целях. С 2008 г. применение ингибиторов миостатина в спорте запрещено.
