- •Общие понятия
- •29. Первое начало термодинамики. Внутренняя энергия, теплота. Работа газа при расширении.
- •30. Температура. Температурные шкалы. Теплоемкость и внутренняя энергия идеального газа. Теплоемкости Ср и Сv
- •31.Уравнение состояния идеального газа. Изопроцессы. Адиабатический процесс. Политропический процесс.
- •32. Реальные газы. Уравнение Ван-дер-Ваальса.
- •33. Давление газа на стенку. Основное уравнение молекулярно-кинетической теории идеальных газов
- •34. Барометрическая формула. Распределение Больцмана.
- •35. Средняя энергия молекул. Число степеней свободы газовых молекул и теплоемкость газов. Закон равнораспределения энергии по степеням свободы. Трудности классической теории теплоемкости газов.
- •36. Скорости газовых молекул. Распределение Максвелла. Наиболее вероятная, средняя арифметическая и среднеквадратичная скорости газовых молекул.
- •37. Средняя длина свободного пробега газовых молекул.
- •38. 39. Второе начало термодинамики. Тепловые машины. Теорема Карно. Цикл Карно. Кпд цикла Карно.
- •40. Энтропия. Статистический смысл энтропии и 2-го начала термодинамики.
- •41. Фазовые превращения. Скрытая теплота фазового перехода. Равновесие между паром и жидкостью. Изотерма реального газа. Критическое состояние. Метастабильные состояния.
- •42. Плавление и кристаллизация. Диаграмма состояния. Уравнение Клапейрона — Клаузиуса.
31.Уравнение состояния идеального газа. Изопроцессы. Адиабатический процесс. Политропический процесс.
Идеальный газ можно рассматривать как совокупность беспорядочно движущихся молекул-шариков, имеющих пренебрежимо малый собственный объем и не взаимодействующих друг с другом на расстоянии.
Законы, описывающие поведение идеальных газов.
Процесс, происходящий при постоянной температуре, называется изотермическим:
Для данной массы газа m при постоянной температуре T произведение давления p на объем V есть величина постоянная: pV=const при T=const и m=const.
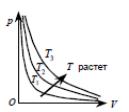
Кривая, изображающая зависимость между p и V , характеризующая свойства вещества при постоянной температуре, называется изотермой. Изотермы — гиперболы, расположенные на графике тем выше, чем выше температура происходящего процесса
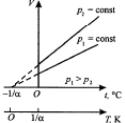
Процесс, происходящий при постоянном давлении, называется изобарным:
Для данной массы газа m при постоянном давлении p отношение объема V к температуре T есть величина постоянная.
V/T=const при p=const и m=const.
Кривая (Рис.2, нижний график), изображающая зависимость между V и T, характеризующая свойства вещества при постоянном давлении, называется изобарой. Если использовать температуру по шкале Цельсия, то закон можно записать в следующей форме V=Vo(1+t), где =1/273 oC-1, Vo – объем при 0oC.
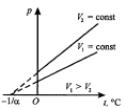
Процесс, происходящий при постоянном объеме, называется изохорным:
Для данной массы газа m при постоянном объеме V отношение давления p к температуре T есть величина постоянная.
p/T=const при V=const и m=const.
Кривая (Рис.2, верхний график), изображающая зависимость между p и T, характеризующая свойства вещества при постоянном объеме, называется изохорой. Если использовать температуру по шкале Цельсия, то закон можно записать в следующей форме p=po(1+t), где =1/273 oC-1, а po – давление при 0oC.
Уравнением состояния термодинамической системы называется уравнение, которое связывает давление p , объем V и температуру T термодинамической системы, находящейся в состоянии термодинамического равновесия: f(p,V,T)=0, где каждая из переменных является функцией двух других.
Уравнение состояния идеального газа:
![]()
По закону Авогадро, при одинаковых p и T один моль любого газа занимает одинаковый молярный объем Vm.
Уравнение состояния для одного моля идеального газа:
![]() ,
где константа R=8,31 Дж/(моль·К) -
называется универсальной газовой
постоянной.
,
где константа R=8,31 Дж/(моль·К) -
называется универсальной газовой
постоянной.
Уравнение Менделеева-Клапейрона — уравнение состояния для массы m идеального газа (т.е =m/ молей, где – молярная масса):
![]()
Если
использовать постоянную Больцмана:
k=1,38 10-23 Дж/К и
R=k*NA
(NA
– число Авагадро), то уравнение
состояния примет вид:
![]() ,
где n — концентрация
молекул — число молекул в единице
объема.
,
где n — концентрация
молекул — число молекул в единице
объема.
Адиабатический процесс - это процесс, происходящий без теплообмена с внешней средой. Такие процессы происходят в теплоизолированных системах. К адиабатическим процессам можно отнести все быстропротекающие процессы в не теплоизолированных системах (теплообмен не успевает совершиться). Несмотря на то, что в пределах большого объема состояние газа в этом случае не является равновесным, поведение газа в пределах достаточно малых объемов вполне можно описать уравнением адиабаты.
Найдем уравнение, связывающее параметры состояния идеального газа для адиабатического процесса.
Для этого запишем
первое начало термодинамики для
адиабатического процесса (4) с учетом
того, что
![]() равно
нулю, то:
равно
нулю, то:
![]()
следовательно
![]() (15).
(15).
Воспользуемся уравнением Менделеева - Клапейрона:
![]() .
.
Подставим (16) в уравнение (15). Получим:
![]() или
или
![]() .
.
Уравнение (13)
преобразуем как
![]() ,
,
из чего следует, что
![]() .
.
Или
![]() .
Учитывая, что
.
Учитывая, что
![]() ,
можно записать
,
можно записать
![]() .
.
Заменив Т
на
![]() ,
получаем соотношение
,
получаем соотношение
![]() ,
,
т.е. уравнение состояния для адиабатического процесса, называемое уравнением Пуассона.
Поскольку
 >1,
то очевидно, что адиабата идет круче
изотермы, уравнение которой pV=const
>1,
то очевидно, что адиабата идет круче
изотермы, уравнение которой pV=const
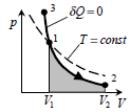
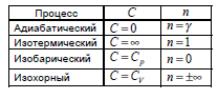
Политропический процесс – это процесс, при котором теплоемкость газа остается постоянной. pVn=const При этом показатель политропы n равен
![]() ,
,
Рассмотренные выше изохорный, изотермический, изобарный и адиабатический процессы — это частные случаи политропного процесса.
Значения теплоемкости и показателя политропы для разных процессов приведены в таблице. Теплоемкость при изотермическом процессе бесконечно велика, поскольку dT=0.
Теплоемкость при адиабатическом процессе равна нулю, поскольку =0.