
- •Общие понятия
- •29. Первое начало термодинамики. Внутренняя энергия, теплота. Работа газа при расширении.
- •30. Температура. Температурные шкалы. Теплоемкость и внутренняя энергия идеального газа. Теплоемкости Ср и Сv
- •31.Уравнение состояния идеального газа. Изопроцессы. Адиабатический процесс. Политропический процесс.
- •32. Реальные газы. Уравнение Ван-дер-Ваальса.
- •33. Давление газа на стенку. Основное уравнение молекулярно-кинетической теории идеальных газов
- •34. Барометрическая формула. Распределение Больцмана.
- •35. Средняя энергия молекул. Число степеней свободы газовых молекул и теплоемкость газов. Закон равнораспределения энергии по степеням свободы. Трудности классической теории теплоемкости газов.
- •36. Скорости газовых молекул. Распределение Максвелла. Наиболее вероятная, средняя арифметическая и среднеквадратичная скорости газовых молекул.
- •37. Средняя длина свободного пробега газовых молекул.
- •38. 39. Второе начало термодинамики. Тепловые машины. Теорема Карно. Цикл Карно. Кпд цикла Карно.
- •40. Энтропия. Статистический смысл энтропии и 2-го начала термодинамики.
- •41. Фазовые превращения. Скрытая теплота фазового перехода. Равновесие между паром и жидкостью. Изотерма реального газа. Критическое состояние. Метастабильные состояния.
- •42. Плавление и кристаллизация. Диаграмма состояния. Уравнение Клапейрона — Клаузиуса.
Общие понятия
Термодинамика и молекулярная физика.
Статистический и термодинамический методы исследования.
Молекулярная физика и термодинамика — разделы физики, в которых изучаются зависимости свойств тел от их строения, взаимодействия между частицами, из которых состоят тела, и характера движения частиц. Для исследования физических свойств макроскопических систем, связанных с огромным числом содержащихся в них атомов и молекул, применяют два качественно различных и взаимно дополняющих друг друга метода: статистический (или молекулярно-кинетический) и термодинамический.
Статистический метод — это метод исследования систем из большого числа частиц, оперирующий статистическими закономерностями и средними (усредненными) значениями физических величин, характеризующих всю систему. Этот метод лежит в основе молекулярной физики — раздела физики, изучающего строение и свойства вещества исходя из молекулярно- кинетических представлений, основывающихся на том, что все тела состоят из атомов, молекул или ионов находящихся в непрерывном хаотическом движении. В дальнейшем мы будем использовать термин "молекула" имея ввиду мельчайшую структурную единицу (элемент) данного вещества.
Термодинамический метод — это метод исследования систем из большого числа частиц, оперирующий величинами, характеризующими систему в целом (например, давление, объем, температура) при различных превращениях энергии, происходящих в системе, не учитывая при этом внутреннего строения изучаемых тел и характера движения отдельных частиц. Этот метод лежит в основе термодинамики — раздела физики, изучающего общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Термодинамическая система. Термодинамика имеет дело с термодинамической системой — совокупностью макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами (внешней средой). Термодинамические системы, не обменивающиеся с внешней средой ни энергией, ни веществом, называются замкнутыми. Основа термодинамического метода — определение состояния термодинамической системы. Состояние системы задается термодинамическими параметрами (параметрами состояния) — совокупностью физических величин, характеризующих свойства термодинамической системы. Обычно в качестве параметров состояния выбирают температуру, давление и объем. Параметры состояния системы могут изменяться. Любое изменение в термодинамической системе, связанное с изменением хотя бы одного из ее термодинамических параметров, называется термодинамическим процессом. Если для данной системы внешние условия не изменяются и состояние системы с течением времени не меняется, то эта система находится в термодинамическом равновесии.
29. Первое начало термодинамики. Внутренняя энергия, теплота. Работа газа при расширении.
Свойства тел при их механическом и тепловом взаимодействия друг с другом достаточно хорошо могут быть описаны на основе молекулярно - кинетической теории. Согласно этой теории все тела состоят из мельчайших частиц – атомов, молекул или ионов, которые находятся в непрерывном хаотическом движении, называемом тепловым, и взаимодействуют между собой. Движение этих частиц подчиняется законам механики. Состояние системы таких частиц определяется совокупностью значений ее термодинамических параметров (или параметров состояния), т.е. физических величин, характеризующих макроскопические свойства системы. Обычно в качестве параметров состояния выбирают температуру, давление, удельный объем. Внутренней энергией такой системы называется энергия, зависящая только от состояния термодинамической системы. Внутренняя энергия системы состоит из кинетической энергии молекул, составляющих систему, потенциальной энергии их взаимодействия друг с другом, внутримолекулярной энергии (т.е. энергии взаимодействия атомов или ионов в молекулах, энергии электронных оболочек атомов и ионов, внутриядерной энергии) и энергии электромагнитного излучения в системе.
Система может обладать также и внешней энергией, которая представляет собой сумму кинетической энергия движения системы как целого (кинетической энергии центра масс системы) и потенциальной энергии системы в поле внешних сил. Внутренняя и внешняя энергия составляют полную энергию системы.
Однако строгий подсчет внутренней энергии тела затруднен. Внутренняя энергия может быть определена только с точностью до постоянного слагаемого, которое нельзя найти методами термодинамики. Но в большинстве случаев приходится иметь дело только с изменениями внутренней энергии U, а не с ее абсолютным значением U, поэтому отсчет внутренней энергии можно вести от внутримолекулярной энергии, которую в большинстве случаев можно считать постоянным слагаемым. Чаще всего за нуль внутренней энергии (U=0) принимают энергию, которой обладает система при абсолютном нуле (т.е. T=0 K).
Внутреннюю энергию тела можно изменить путем теплообмена или механическим воздействием, т.е. производя над телом работу. Теплообмен и механическое воздействие в ряде случаев могут приводить к одинаковым изменениям внутренней энергии тела. Это дает возможность сравнивать теплоту и работу и измерять их в одинаковых единицах. Теплота представляет собой энергию, которая передается от одного тела к другому при их контакте или путем излучения нагретого тела, т.е. по существу мы имеем дело с работой, которую совершают уже не макроскопические тела, а хаотически движущиеся микрочастицы. Таким образом, термодинамическая система может получать или отдавать некоторое количество теплоты Q, может производить работу или над ней может быть произведена работа. Совершение системой или над системой работы является перемещение взаимодействующих с ней внешних тел. В случае квазистатического, равновесного процесса элементарная работа A, совершенная для изменения объема тела на величину dV, равна
![]() ,
где p - давление.
,
где p - давление.
Данная работа A называется работой расширения и представляет собой работу, которую система производит против внешних сил.
Полная работа при переходе системы из состояния с объемом V1 в состояние с объемом V2 будет равна
 .
.
Из геометрического смысла определенного интеграла следует, что работа А, совершаемая системой при переходе из первого состояния во второе, будет равна площади под кривой, описывающей данный процесс в координатах p, V (т.е. заштрихованной площади криволинейной трапеции, см. рис.1). Следовательно, работа зависит не только от начального и конечного состояния системы, но и от того каким образом был осуществлен переход из одного состояния в другое.
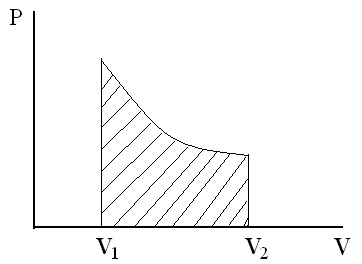
Рис.1.
Работа, как и теплота, зависит от того, каким образом осуществляется процесс. Работа и теплота наряду с внутренней энергией также являются формами энергии. Закон сохранения энергии в термодинамике называют первым началом (или первым законом) термодинамики.
Для практического использования первого начала термодинамики надо условиться о выборе знака для теплоты и работы. Теплоту будем считать положительной, когда она сообщается системе, а работу положительной, когда система совершает ее против действия внешних сил.
Первое начало термодинамики формулируется следующим образом: количество сообщенного системе тепла Q расходуется на изменение внутренней энергии системы dU и совершение работы A этой системой над внешними телами.
![]() (4)
(4)
Внутренняя энергия является полным дифференциалом. Она не зависит от вида процесса, а определяется только начальным и конечным состоянием системы. При циклическом процессе изменение внутренней энергии равно нулю, т.е. Q=A.
