
- •1. Реакции, которые могут идти по-разному в зависимости от условий.
- •1.3. Взаимодействие пропена с хлором.
- •1.4. Реакции дегидратации спиртов.
- •1.5. Реакция окисления кумола (изопропилбензола).
- •1.6. Реакция восстановления нитробензола.
- •2. Преимущественные направления протекания некоторых реакций
- •2.4. Замещение в предельном радикале у разных классов веществ.
- •2.5. Правила ориентации в бензольном кольце.
- •3. Реакции, которые не рассматриваются в школьном курсе.
- •Задание
Денисова В.Г. Мастер-класс «Химические свойства веществ в заданиях ЕГЭ»
Занятие 7. Химические свойства и получение органических веществ в заданиях С3. Реакции, вызывающие наибольшие сложности у школьников, выходящие за рамки школьного курса.
Для решения заданий С3 школьникам нужно знать весь курс органической химии на профильном уровне. Конечно, мы не будем в рамках мастер-класса вспоминать свойства всех классов органических веществ и способы их получения.
В рамках этого занятия мне хотелось бы обратить ваше внимание:
1) на реакции, которые могут идти по-разному в зависимости от условий;
2) на преимущественные направления протекания некоторых реакций;
3) на реакции, которые не рассматриваются в школьном курсе, но используются в заданиях ЕГЭ.
1. Реакции, которые могут идти по-разному в зависимости от условий.
1.1. Взаимодействие галогеналканов с щелочами
При действии на галогеналкан водного раствора щелочи получается спирт (идет реакция замещения): С2Н5Cl + NaOH (водн.) → С2Н5ОН + NaCl
При действии на галогеналкан спиртового раствора щелочи получается алкен (идет реакция отщепления): С2Н5Cl + NaOH (спирт.) → С2Н4 + NaCl + Н2О
1.2. Взаимодействие гомологов бензола с галогенами
П ри
взаимодействии гомологов бензола с
галогенами при нагревании в присутствии
галогенидов железа (кислот Льюиса) идет
замещение в
бензольном кольце
(в орто- или пара-положении). Чем объемнее
радикал, тем вероятнее замещение в
пара-положении (влияние пространственного
фактора).
ри
взаимодействии гомологов бензола с
галогенами при нагревании в присутствии
галогенидов железа (кислот Льюиса) идет
замещение в
бензольном кольце
(в орто- или пара-положении). Чем объемнее
радикал, тем вероятнее замещение в
пара-положении (влияние пространственного
фактора).
 FeBr3,
toC
FeBr3,
toC
+ Br2 → + HBr
 Br
Br
П ри
взаимодействии гомологов бензола с
галогенами на свету идет замещение в
радикале (в
α-положении, то есть ближайшем к
бензольному кольцу).
ри
взаимодействии гомологов бензола с
галогенами на свету идет замещение в
радикале (в
α-положении, то есть ближайшем к
бензольному кольцу).
свет, toC

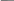 CH2
– CH3
+ Br2
→ CHBr – CH3
+ HBr
CH2
– CH3
+ Br2
→ CHBr – CH3
+ HBr
1.3. Взаимодействие пропена с хлором.
При взаимодействии пропена с хлорной водой при обычных условиях происходит присоединение по месту разрыва π- связи:
CH3 – CH = CH2 + Cl2 → CH3 – CHCl – CH2Cl
При взаимодействии пропена с газообразным хлором при 500оС идет замещение в метильном радикале. Это первая стадия промышленного производства глицерина.
500оС
CH3 – CH = CH2 + Cl2 → CH2Cl – CH = CH2 + HCl
1.4. Реакции дегидратации спиртов.
При температурах выше 140оС в присутствии избытка серной концентрированной кислоты происходит внутримолекулярная дегидратация спиртов с образованием алкенов: С2Н5ОН → С2Н4 + Н2О
! Внутримолекулярная дегидратация этанола может идти в присутствии оксида алюминия.
При температурах ниже 140оС в присутствии недостатка серной концентрированной кислоты происходит межмолекулярная дегидратация спиртов с образованием простых эфиров: 2С2Н5ОН → С2Н5–О–С2Н5 + Н2О
Для этанола так же возможна реакция Лебедева, которая идет в присутствии оксида цинка и оксида алюминия:
2С2Н5ОН → СН2=СН – СН = СН2 + 2Н2О + Н2
1.5. Реакция окисления кумола (изопропилбензола).
В присутствии перманганата калия или других окислителей в сернокислом растворе при нагревании происходит деструктивное окисление с образованием бензойной кислоты и углекислого газа:
 СН3
СН3

 СН
+ [O]
→ COOH
+ 2CO2
+ H2O
СН
+ [O]
→ COOH
+ 2CO2
+ H2O
СН3
В присутствии кислорода и раствора серной кислоты образуется ацетон и фенол:

 CH3
O
CH3
O

 CH
+ O2
→ OH + CH3
– C – CH3
CH
+ O2
→ OH + CH3
– C – CH3
CH3
Окисление органических веществ мы с вами подробно рассматривали в занятии № 2. Рекомендую вам вспомнить содержание этого занятия, прежде чем вы приступите к выполнению задания.
