
- •Непредельные (ненасыщенные) углеводороды.
- •Способы получения алкенов
- •Химические свойства.
- •Алкины.
- •Ароматические соединения.
- •Классификация заместителей. Понятие об ориентирующем влиянии заместителей
- •Галогенопроизводные алифатических углеводородов Нуклеофильное замещение в алифатическом ряду
- •Кинетика нуклеофильного замещения в алифатическом ряду Реакции первого и второго порядка
- •Реакции элиминирования (отщепления): е1 и е2
- •Сравнение реакций элиминирования и замещения.
Кинетика нуклеофильного замещения в алифатическом ряду Реакции первого и второго порядка
Рассмотрим в качестве примера реакцию бромистого метила с едким натром, в результате которой образуется спирт. Реакцию проводят в водном этиловом спирте, в котором растворяются оба реагента.
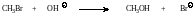
Установлено, что скорость реакции зависит от концентрации обоих реагентов – щелочи [ОH−]о, что скорость реакции зависит от концентрации обоих реагентов - щелочи в результате которой образуется спирт. ируются в лаб] и бромистого метила [СН3Br] в соответствии с уравнением
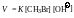
Данная реакция является реакцией второго порядка.
Рассмотрим другую реакцию – трет-бутилбромида со щелочью (едкий натр).
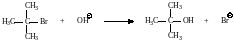
Было установлено, что эта реакция зависит только от концентрации трет-бутил-бромида и является реакцией первого порядка.
Для объяснения различного кинетического порядка реакции, а также других наблюдений, было высказано предположение и затем доказано, что реакция нуклеофильного замещения может протекать по двум различным механизмам.
SN2-Реакция, механизм, кинетика и реакционная способность. Реакция бромистого метила с гидроксил-ионом, приводящая к метиловому спирту, является реакцией второго порядка, т.е. скорость реакции зависит от концентрации обоих реагентов. В качестве простейшего объяснения можно принять, что реакция требует столкновения между ионом гидроксила и молекулой бромистого метила и протекает следующим образом:
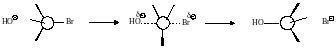
Гидроксил-ион сталкивается с молекулой бромистого метила со стороны, наиболее удаленной от брома, и когда такое столкновение имеет достаточную энергию, образуется связь С―ОН, а связь С―Br разрывается и ион брома отщепляется.
Переходное состояние можно представить как структуру, в которой атом углерода частично связан с ОН и Br; связь С―ОН, еще полностью не образовалась а связь С―Br еще не совсем разорвалась. Группы ОН и Br располагаются на максимально возможном расстоянии друг от друг; три атома водорода и углерода лежат в одной плоскости, причем все углы между связями равны 120о. Таким образом, связи С―Н расположены как спицы в колесе, а связи С―ОН и С―Br ориентированы вдоль оси.
Этот механизм называется SN2 – нуклеофильное бимолекулярное замещение. Термин бимолекулярное используется здесь, поскольку стадия, определяющая скорость реакции, включает столкновение двух частиц.
По мере увеличения числа заместителей, связанных с атомом углерода, несущим галоген, реакционная способность в реакции SN2-замещения уменьшается. Различие в скоростях определяется главным образом пространственными факторами, т.е. различия в скоростях связаны с объемом заместителей, а неспособность подавать или оттягивать электроны. Заместители могут быть как алифатическими, так и ароматическими.
В SN2-реакциях реакционная способность RX уменьшается в следующем порядке:
СН3X > первичный > вторичный > третичный.
SN1-Реакция, механизм, кинетика и реакционная способность.
Реакция между трет-бутилбромидом и гидроксил-ионом является реакцией первого порядка и зависит только от концентрации трет-бутилбромида. Это означает, что гидроксил-ион не участвует в реакции, определяющей скорость реакции.
Эти наблюдения находятся в соответствии со следующим механизмом:
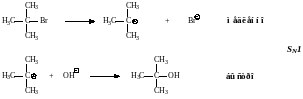
Суммарная скорость реакции определяется скоростью медленного разрыва связи С―Br с образованием карбокатиона, который затем быстро реагирует с гидроксил-ионом, давая конечный продукт. Этот механизм называется SN1: мономолекулярное нуклеофильное замещение.
Стадией, определяющей скорость реакции при SN1-замещении, является стадия образования карбокатиона. Следует ожидать, что реакционная способность алкилгалогенида зависит главным образом от устойчивости карбокатиона. Действительно, реакционная способность алкилгалогенидов RX изменяется в том же порядке, что и устойчивость карбокатионов:
аллил, бензил > третичный > вторичный > первичный > СН3Х
Сравнение SN1 и SN2-реакций.
В ряду метильный, первичный, вторичный третичный галогеналкилы реакционная способность, следовательно, скорость реакций нуклеофильного замещения в зависимости от механизма изменяется следующим образом:
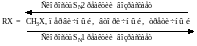
Порядок изменения реакционной способности в SN1 и SN2-реакциях различен, поэтому для вторичных галогеналкилов характерно наличие минимума реакционной способности. Для них характерен смешанный механизм.
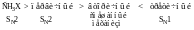
Несмотря на склонность определенного класса галогеналкилов к определенному механизму, можно в какой-то степени контролировать реакцию, изменяя условия ее проведения.
1. Высокая концентрация нуклеофильного реагента благоприятствует SN2-реакции, а низкая концентрация наоборот способствует SN1 реакции.
2. Природа нуклеофильного реагента также играет важную роль: сильный нуклеофил способствует SN2- механизму (например этилат-ион), а слабый (этиловый спирт) SN1 механизму.
3. Растворитель с большей полярностью, большей энергией сольватации способствует образованию ионов, т.е. протеканию реакции по SN1 механизму.
