
- •Непредельные (ненасыщенные) углеводороды.
- •Способы получения алкенов
- •Химические свойства.
- •Алкины.
- •Ароматические соединения.
- •Классификация заместителей. Понятие об ориентирующем влиянии заместителей
- •Галогенопроизводные алифатических углеводородов Нуклеофильное замещение в алифатическом ряду
- •Кинетика нуклеофильного замещения в алифатическом ряду Реакции первого и второго порядка
- •Реакции элиминирования (отщепления): е1 и е2
- •Сравнение реакций элиминирования и замещения.
Алкины.
Непредельные соединения, содержащие в молекулу тройную связь, называют ацетиленовыми углеводородами или алкинами. Общая формула как у диеновых углеводородов, СnH2n-2.
Строение тройной связи было рассмотрено ранее – это комбинация двух π- и одной σ-связи. Длина тройной связи равна 0,120 нм, энергия образования 838,3 кДж/моль.
Номенклатура. В названиях алканов суффикс -ан заменяют на –ин. Главная цепь должна обязательно содержать тройную связь. Цепь нумеруют с того конца, к которому ближе расположена тройная связь.
Изомерия алкинов – изомерия положения тройной связи в цепи и углеродного скелета.
Способы получения.
1. Разложение карбида кальция водой.
СаС2 + 2Н2О → С2Н2 + Са(ОН)2
2. Дегидрогалогенирование дигалогенопроизводных, содержащих атомы галогена у одного или у соседних атомов углерода, действием спиртовой щелочи.
СН3 – СН2 – СНCl2 + 2KOH → CH3 – C ≡CH + 2KCl + 2H2O
3. Крекинг природного газа или нефти.
1500 °С
2СН4 → С2Н2 + 3Н2
4. Алкилирование ацетиленидов металлов.
СН3–I + Na–С≡СН → СН3−С≡СН + NaI
Физические свойства. (по Артеменко)
Химические свойства. Ацетиленовые углеводороды (алкины) способны вступать в реакции присоединения, замещения, окисления, полимеризации и конденсации.
Реакции присоединения. Реакции присоединения у алкинов протекают ступенчато: присоединяя одну молекулу реагента, тройная связь переходит в двойную, а присоединением второй молекулы – в одинарную. Имея две π-связи, алкины тем не менее медленнее вступают в реакции электрофильного присоединения, чем алкены. Это связано с устойчивостью промежуточных частиц: винильный катион, образующийся при присоединения электрофильной частицы в алкину, менее устойчив, чем карбокатион, образующийся при присоединении электрофила к алкену.
НС≡СН + А+ → НАС=СН+ (винил-катион)
Н2С=СН2 + А+ → Н2АС−СН2+ (карбокатион)
Энергия активации образования винил-катиона выше, чем для алкил-катиона, поэтому реакция электрофильного присоединения к алкинам протекает медленней, чем к алкенам.
Гидрирование. В присутствии катализаторов (Pt, Pd, Ni) происходит восстановление алкинов в алкены и алканы.
Н2 Н2
СН≡CН → CН2=СН2 → СН3 – СН3
Галогенирование ацетилена протекает с меньшей скоростью, чем реакция с этиленом. Br2 Br2
СН≡CН → CНBr=СНBr → СНBr2 – СНBr32
Гидрогалогенирование:
НСl НСl
СН≡CН → CН2=СНСl → СН3 – СНCl2
У алкенов эта реакция идет легче. Вторая молекула НСl присоединяется в соответствии с правилом Марковникова.
Присоединение воды (реакция Кучерова).
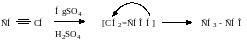
Присоединение органических кислот.
СН3 – СООН + СН≡CН → СН3 – СОО–СН=СН2
Сложный эфир – винилацетат применяют в качестве мономера для получения поливинилацетата.
Реакции полимеризации. Тримеризация ацетилена
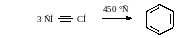
Реакции замещения. Атомы водорода в ацетилене обладают очень слабокислыми свойствами (как кислота в 1033 раз слабее НСl). В sp3-гибридном состоянии появляется небольшая кислотность за счет смещения электронной плотности.
δ+ δ− δ− δ+
Н→С≡C←Н
Такой поляризации достаточно, чтобы атомы водорода заменились на металл в щелочной среде.
СН≡CН + 2[Ag(NН3)2]OH → Ag−C≡C−Ag + 4NH3 + 2H2O
Лекция 7
