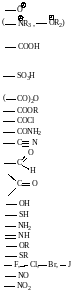- •Непредельные (ненасыщенные) углеводороды.
- •Способы получения алкенов
- •Химические свойства.
- •Алкины.
- •Ароматические соединения.
- •Классификация заместителей. Понятие об ориентирующем влиянии заместителей
- •Галогенопроизводные алифатических углеводородов Нуклеофильное замещение в алифатическом ряду
- •Кинетика нуклеофильного замещения в алифатическом ряду Реакции первого и второго порядка
- •Реакции элиминирования (отщепления): е1 и е2
- •Сравнение реакций элиминирования и замещения.
Лекция 1.
ПРЕДМЕТ ОРГАНИЧЕСКОЙ ХИМИИ.
Основным элементом, входящим в состав органических соединений, является углерод. Поэтому Бутлеров определил органическую химию как химию соединений углерода. Однако существуют простые вещества, содержащие углерод (СО2, СО, НСN и ее соли и др.) которые относят к неорганическим соединениям. Поэтому, органическую химию следует определять как химию углеводородов и их производных в состав которых могут входить почти все элементы периодической системы.
Выделение органической химии в самостоятельный раздел химической науки вызвано рядом причин.
Первая связана с многочисленностью органических соединений, в настоящее время их известно около 10 млн., а неорганических – около 600 тыс.
Вторая заключается в сложности и своеобразии органических веществ, по сравнению с неорганическими соединениями. Основной причиной многообразия органических соединений является способность атома углерода соединяться не только с другими атомами, но и друг с другом, образуя прямые, разветвленные и замкнутые углеродные цепи. Температуры плавления и кипения органических соединений ниже, чем неорганических, они легко разрушаются при сравнительно невысоких температурах, по сравнению с неорганическими соединениями. Большинство химических реакций органических соединений протекает гораздо медленней, чем ионные реакции, характерные для неорганических соединений, что обусловлено природой основной химической связи в органических соединениях – ковалентной связи. Кроме того, в органической химии появляются новые понятия и явления: органический радикал, функциональная группа, изомерия, гомологи, взаимное влияние атомов и групп атомов в молекуле и др.
Третья причина выделения органической химии в отдельную науку заключается в том, что многие органические вещества играют исключительно важную роль для человека, так как они находят разносторонне практическое применение (лекарственные препараты, полимерные материалы, искусственные ткани и каучуки, органические красители и т.д.). Кроме того, органическая химия изучает вещества, многие их которых непосредственно связаны с процессами жизнедеятельности животных и растительных организмов, например, такие как белки и нуклеиновые кислоты, ответственные, в том числе за передачу генетической информации.
Однако, провести резкую грань между органической и неорганической химией нельзя, поскольку обе подчиняются одним и тем же законам природы. При этом необходимо помнить, что органическая химия – наука о более высокой форме организации материи. В этом ее отличительная особенность.
В 1828 году Веллер, нагревая раствор ционата аммония, получил мочевину – органическое вещество, являющееся продуктом жизнедеятельности живого организма:
NH4CNO → H2N─CO─NH2
Ф. Энгельс по этому поводу писал, что благодаря получению неорганическим путем таких химических соединений, которые до того времени порождались только в живом организме, было доказано, что законы химии имеют ту же силу для органических тел, что и для неорганических. С того времени началось крушение существовавшей до этого виталистической теории Берцелиуса, утверждавшей, что в «живой природе элементы повинуются иным законам, чем в безжизненной», и что органические вещества могут получаться только под воздействием особой «жизненной силы».
Особенно быстро начинает развиваться органическая химия с 60-х годов XIX века, когда А.М.Бутлеров создал теорию химического строения органических соединений, ставшую научной основой для дальнейшего развития исследований в этой области химии. В начале прошлого века на базе важнейших исследований по органической химии, связанных с именами выдающихся российских ученых А.М. Бутлерова, Н.Н.Зинина, В.В.Морковникова, Е.Е.Вагнера, Н.Д.Зелинского, А.Ф.Фаворского, С.В.Лебедева и др., была создана нефте- и газоперерабатывающая промышленность, началось производство пластмасс, искусственных волокон и синтетических каучуков. Стала развиваться химия красителей, лекарственных веществ, витаминов и моющих средств. В наши дни без органической химии нельзя представить машиностроение, самолетостроение, транспорт, электротехническую промышленность сельское хозяйство и медицину. Незаменимы в строительной индустрии пластмассы, полимерцементы и полимербетоны, клеи и герметики, кремнийорганические соединения, поверхностно-активные вещества, полимерные красители и другие продукты.
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ В ОРГАНИЧЕСКОЙ ХИМИИ.
1.Доструктурные теории. Накопление большого экспериментального материала в органической химии потребовало создания теории, объясняющей наблюдаемые факты.
Первой теорией была «теория радикалов» (Берцелиус, Либих, Веллер, Гей-Люссак). В основе этой теории было принято понятие об «органическом радикале» - группе из нескольких атомов, которая может переходить без изменения из одной молекулы (исходное вещество) в другую (продукт реакции). Поскольку Берцелиус рассматривал органические вещества как системы, состоящие из органического радикала (с положительным зарядом) и простого неорганического остатка (заряженного отрицательно), связанных с помощью электростатического взаимодействия, теория радикалов известна еще и как дуалистическая теория (от лат. duos – два). Сторонники этой теории рассматривала радикал как абсолютно устойчивую и неизменяемую часть молекулы. Это основная ошибка теории.
В 40-х годах XIX века возникла другая теория – «теория типов» (Жерар, Лоран, Дюма). В противоположность «теории радикалов» она рассматривала масть молекулы, изменяющуюся в ходе химической реакции. Согласно этой теории все известные в то время органические вещества были отнесены по характеру их химических превращений к пяти типам:
Н Н Н Н Н
O Н Н
Н Сl H N C
H H
H H
водорода хлороводорода воды аммиака углерода
При замене атома водорода в любом из этих типов на радикал можно получить различные органические соединения. Однако с развитием органической химии накопление фактических данных уже не укладывалось в известные типы. Сложилась критическая ситуация для этой теории. Выход из этого мог быть только в создании новой теории.
Для появления новой теории были созданы некоторые предпосылки. Было установлено, что углерод проявляет валентность равную четырем (Кекуле, Кольбе), и что его атомы способны соединяться друг с другом в длинные цепи. Была также предложена (Купер) система изображения отдельных связей с помощью черточек-символов.
Теория химического строения органических соединений А.М.Бутлерова.
Основная идея этой теории была сформулирована Бутлеровым 1861 г в статье «О химическом строении вещества». Сущность этой теории можно кратко сформулировать в виде следующих положений.
Атомы, входящие в состав молекулы органического вещества, не находятся в беспорядочном состоянии, а соединены между собой в определенной последовательности химическими связями (согласно валентности этих атомов). Последовательность соединения атомов в молекуле Бутлеров назвал химическим строением.
От строения молекул, т.е. от того, в каком порядке соединены между собой атомы в молекуле, зависят свойства вещества.
Зная свойства вещества, можно установить его строение, и наоборот: химическое строение может много сказать о его свойствах.
Химические свойства атомов и атомных группировок не являются постоянными, а зависят от других атомов (атомных групп), находящихся в молекуле. При этом наиболее сильное влияние наблюдается в случае, если они связаны друг с другом непосредственно.
Строение молекулы можно выразить при помощи структурной формулы, которая для данного вещества является единственной.
В процессе создания теории строения Бутлеров пришел к мысли, что органические соединения должны иметь пространственное строение. Это было вызвано в первую очередь тем, что некоторые виды изомерии (геометрическая и оптическая) трудно было объяснить с точки зрения плоского строения молекул. Эта догадка была подтверждена Вант-Гоффом и Ле-Белем, независимо выдвинувшими идею о тетраэдрической направленности связей атома углерода.
Сегодня сущность этой теории можно выразить следующим образом:
физические и химические свойства органических соединений определяются составом их молекул, а также химическим, пространственным и электронным строением.
Изображение органических соединений с помощью структурных формул.
Изображения органических соединений с помощью символов и черточек для обозначения химических связей называют структурными формулами. Например:
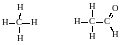
Простая связь (σ-связь) обозначается одной черточкой, двойная – двумя, тройная – тремя. Число черточек у элемента соответствует его валентности. Обычно структурные формулы записывают в более сокращенном виде:
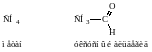
При изображении циклических соединений начертания символов углерода и водорода вообще опускают, а их присутствие при этом подразумевается.
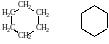
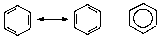
Циклогексан бензол
Нельзя забывать, что любая даже очень удачная структурная формула – это всего лишь абстрактный образ молекулы. Она является отображением реальной структуры и выражением свойств органической молекулы.
Электронное строение атомов. Квантовая механика (М.Планк, Л.де Бройль, Э.Шредингер, В.Гейзенберг) изучает движение и энергетическое состояние микрочастиц. Согласно этой теории электрон в атоме обладает двойственной природой: ему приписываются свойства как частицы, так и волны (квантово-волновой дуализм). Движение электрона в поле ядра описывается уравнением Э.Шредингера (1926), которое устанавливает соотношение между полной энергией электрона и волновой функцией ψ, характеризующей его состояние в атоме.
Квадрат этой функции ψ2 представляет собой вероятность нахождения электрона в определенной точке пространства вокруг ядра, т.е. ψ2 является мерой электронной плотности в данной точке пространства. Такое пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется электронным облаком или орбиталью. Состояние электрона и характер его орбиталей характеризуется четырьмя квантовыми числами, которые вводятся как параметры при решении уравнения Шредингера: главным n, орбитальным l, магнитным ml и спиновым ms.
Главное квантовое число n определяет расстояние орбитали от ядра атома, а значит, и энергию электрона – энергетический уровень орбитали, на котором находится электрон. Энергетический уровень (электронный слой) – совокупность электронов в атоме, имеющих одинаковое значение n. Увеличение главного квантового числа n ведет к возрастанию энергии электрона. Число n может изменяться от 1 до значения, соответствующего номеру периода в котором находится данный элемент. Энергетические уровни (1, 2, 3 и т.д.) обозначают также латинскими заглавными буквами K, L, M и т.д.
Орбитальное квантовое число l определяет форму (симметрию) орбиталей и связано с моментом импульса движущегося электрона. Оно может принимать целочисленные значения от 0 до n – 1. При n = 1 число l = 1, n = 2, l = 0 и 1. Орбитальное квантовое число определяет число подуровней каждого энергетического уровня. На одном подуровне расположены электроны с одинаковым значением n и l. Для обозначения подуровней используются строчные буквы латинского алфавита – s, p, d и f, поэтому атомные орбитали на соответствующих подуровнях также подразделяют на типы: s, p, d и f. Электроны, образующие s-подуровень, называют s-электронами, р-подуровень,
р – электронами.
Магнитное квантовое число ml определяет пространственную ориентацию орбитали, а также число орбиталей на соответствующем подуровне. Оно изменяется в пределах от – l до + l, включая нуль, т.е. может принимать 2l + 1 значений. При l = 0 ml также равно нулю; в этом случае возможна только одна 1s орбиталь, имеющая форму сферы, в центре которой расположено ядро атома. Орбиталь 1s имеет меньшую по сравнению с другими орбиталями энергию. Орбиталь 2s представляет собой также сферу с ядром в центре, но по размерам больше 1s-орбитали. Она имеет и более высокую энергию. Если l = 1, то ml = –1, 0, +1; при таких значениях ml возможны три гантелеобразных 2р-орбитали, направленные по трем взаимно перпендикулярным осям координат (x, y, z) и обозначаемые как 2рх, 2рy, 2pz. Они обладают равной энергией. Таким образом, для s-подуровня возможна одна 1s (или 2s)-орбиталь, для р-подуровня – три 2р-орбитали.
Спиновое квантовое число ms обусловлено наличием у электрона собственного момента импульса. Оно соответствует двум возможным ориентациям магнитного момента электрона в магнитном поле и имеет два значения: +1/2 и –1/2 (вдоль силовых линий или против.)
Согласно принципу В.Паули (1925) в атоме не может быть электронов с одинаковым набором всех четырех квантовых чисел. Это означает, что на одной орбитали могут находиться электроны с антипараллельными спинами (ms = +1/2 и –1/2), но с одинаковыми значениями n, l, ml. Такие электроны называют спаренными (неподеленная электронная пара). Их обычно условно изображают в виде двух противоположно направленных стрелок, помещенных в квадрат (квадрат – условное обозначение атомной орбитали).
Лекция 2.
Электронное строение атома углерода, типы гибридизации орбиталей.
Углерод – первый элемент IV группы периодической системы элементов. Два его электрона находятся на внутреннем К-уровне, а на внешнем L-уровне, – четыре электрона.
В основном состоянии К- и L-уровни у атома углерода имеют строение
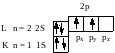
или 1s22s22p2 (1s22s22px2py)
Такое распределение электронов может привести к неверному выводу о том, что углерод является двухвалентным элементом. Действительно, во втором наружном слое спарены только 2s-электрона, а не спарены 2р-электрона и они способны образовывать химические связи. Однако валентность углерода равна 4, и это объясняется тем, что в момент химической реакции атом углерода может переходить из основного состояния (1s22s22p2) в возбужденное (условно обозначается С*). При этом происходит распаривание 2s электронов и переход одного их них на свободную 2pz-орбиталь:
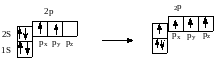
или 1s22s22p3 (1s22s22px2py2pz)
В результате такого перехода образуются четыре неспаренных электрона – один 2s и три 2p. Это возможно потому, что энергия 2s и 2p уровней отличается не очень сильно (676,2 кДж/моль), что затем с избытком компенсируется образованием дополнительно двух связей (412 кДж/моль х 2). При этом можно ошибочно предположить, что в молекуле метана имеется разные связи: одна s–s-связь и три s–p-связи, которые должны отличаться по энергии и направленности. Однако из эксперимента известно, что в метане все связи одинаковы. Для объяснения этого факта было введено понятие о гибридизацци (смешении) орбиталей (Л.Полинг, Ж.Слейтер, 1931). Было показано, что электроны в молекулах, как правило, располагаются не на «чистых» s-и p-орбиталях, а на смешанных – гибридных. Такие орбитали полнее перекрываются с орбиталями других атомов, образуя более прочные связи. Этому способствует форма гибридных орбиталей. В пространстве они располагаются на максимальном удалении друг от друга и обладают одинаковой энергией.
Для атома углерода возможны три валентных состояния с различными типами гибридизации.
sp3-Гибридизация. При этом происходит смешение одной 2s и трех 2p-орбиталей. В результате образуется четыре одинаковые гибридные орбитали, имеющие бóльшую электронную плотность по одну сторону ядра. Поэтому каждая из гибридных орбиталей способна в большей степени перекрываться с орбиталями других атомов, чем отдельные «чистые» 2s- и 2р-орбитали.
Все четыре гибридные орбитали строго ориентированы в пространстве, создавая своими «лепестками» тетраэдр, так как они расположены относительно друг-друга под углом 109о 28´.
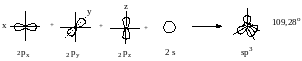
Такая геометрия обеспечивает минимальное отталкивание между четырьмя связывающими парами электронов при углероде в молекуле метана.
Состояние углеродного атома с sp3-гибридными орбиталями часто называют первым валентным состоянием. Оно характерно для предельных углеводородов.
sp2-Гибридизация. Эта гибридизация – результат смешения одной 2s- и двух 2р-орбиталей. При этом образуются три гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу.
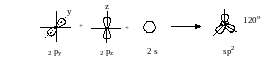
Третья 2р-орбиталь располагается в плоскости, перпендикулярной плоскости гибридных орбиталей и участвует в образовании двойной связи за счет бокового перекрывания (π-связь). Этот тип перекрывания характерен для непредельных углеводородов ряда этилена и называется вторым валентным состоянием.
sр-Гибридизация. При смешении 2s- и 2р-орбиталей образуются две гибридные орбитали, расположенные на одной прямой линии.
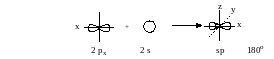
Оставшиеся две 2р-орбитали не принимают участия в гибридизации, расположены во взаимно перпендикулярных плоскостях и за счет бокового перекрывания образуют π-связи тройной связи (непредельные углеводороды ряда ацетилена). Этот тип гибридизации третье валентное состояние углерода.
Гибридизация – это способ объяснить экспериментальные результаты определения углов, длин и энергии различных связей, обусловленные характером электронных орбиталей и их взаимодействием.
Природа и типы химической связи. Основные типы химической связи – ионная и ковалентная.
Ионная связь (электровалентная, гетерополярная). С помощью этой связи построено большинство неорганических соединений. Эта связь возникает между атомами, которые сильно отличаются по электроотрицательности. Процесс образования связи состоит в передаче электрона от одного атома к другому. Образовавшаяся при этом электронная пара перемещается к одному из соединяющихся атомов – возникают два противоположно заряженных иона, с устойчивыми электронными оболочками (октетами), характерными для инертных газов, которые удерживаются друг с другом за счет электростатического взаимодействия. Схематически это можно представить так:
Na· + ·Cl → [ Na ]+ + [ Cl ]¯
Ионная связь имеет свои особенности. Она отличается значительной полярностью, а вещества с такой связью имеют высокую температуру плавления и кипения, хорошей растворимостью в полярных растворителях, электропроводностью растворов и большой скоростью протекания химических реакций с участием ионов.
Ковалентная (гомеополярная) связь. При образовании связи между атомами, электроотрицательности которых равны или отличаются незначительно, передачи электрона от одного атома к другому не происходит.
В этом случае связь образуется за счет обобществления неспаренных электронов (двух, четырех или шести), принадлежавших обоим атомам до образования химической связи. Каждая из этих электронных пар образует только одну ковалентную связь, обозначаемую черточкой:
Cl· + Cl· → Cl : Cl или Cl – Cl
Ковалентная связь – наиболее распространенный тип химической связи в органической химии. Она образуется при перекрывании орбиталей реагирующих атомов с образованием устойчивых электронных оболочек – октетов, а не путем отдачи – присоединения как в случае ионной связи.
Ковалентная связь моде быть простой (одинарной), двойной и тройной.
Связь между атомами, осуществляемая парой электронов, максимальная плотность которых расположена на линии, соединяющей центры этих атомов называют простой (одинарной) или σ (сигма) -связью.
Такая связь может быть образована при перекрывании как s-, так и 2р-электронов, а также электронов, находящихся в sp3-, sp2- и sp-гибридизации. При перекрывании двух 2р-орбиталей σ-связь образуется при условии осевого перекрывания.
В предельных углеводородах, в которых атом углерода находится в sp3-гибрином состоянии, имеются только σ-связи
Если в образовании ковалентной связи принимают участие две или три электронные пары, то такую химическую связь называют кратной. Она может быть двойной (в случае двух пар электронов) или тройной (с участием трех пар электронов.
Кратные связи состоят из одной σ-связи и одной или двух π(пи)-связей. В этом случае σ-связь образована в результате перекрывания sp2-гибридных орбиталей, а π-связь – негибридизованных 2р-орбиталей. Электроны, принимающие участие в образовании π-связи, обычно называют π-электронами.
Двойная углерод-углеродная связь характерна этиленовых углеводородов, а тройная – для ацетиленовых.
Ковалентная связь характеризуется полярностью, поляризуемостью, направленностью, длиной и энергией.
Если в образовании ковалентной связи участвуют атомы с различным сродством к электрону (электрооттрицательностью), то электронная пара связи будет смещена в сторону атома с бóльшей электроотрицательностью и такая ковалентная связь будет полярной. Например в формуле
СН3δ+– Сlδ–
знаки δ+ и δ– означают, что на атоме хлора имеется избыточная электронная плотность (частичный отрицательный заряд), а на атоме углерода – недостаток электронной плотности (частичный положительный заряд). Смещение электронной плотности в молекуле можно также показать стрелкой:
СН3→Сl
Полярность связи может быть количественно охарактеризована с помощью электрических дипольных моментов. Электрический момент диполя (μ = er) является векторной величиной и измеряется в кулон-метрах (Кл·м) или дебаях D (1D = 3,34.10-30 Кл . м).
Поляризуемость связи – способность изменять полярность под воздействием внешнего электромагнитного поля. Такое поле может создавать и атакующий реагент, и растворитель.
Направленность ковалентной связи – основное ее отличие от других видов связи. Направленность означает, что ее образование происходит только в опрделенных напрвлениях пространства.Углы, которые образуют ковалентные связи между собой, связаны с валентныс состоянием углерода. При sp3-гибридизации угол между гибридными орбиталями состаляет 109°28', sp2-гибридизации он равен 120°, а при sp-гибридизации – 180°.
Длина ковалентной связи определяется как расстояние между ядрами, выраженное в нанометрах (1 нм = 10-9 м). Длина связи зависит от ее характера:
чем больше кратность, тем она короче (С–С 0,154 нм; С=С 0,134 нм; С≡С 0,120 нм).
Энергия связи определяется как среднее значение энергий диссоциации связей до нейтральных атомов (А–В → А· + В·, энергия С–С связи 334,7 кДж/моль, С–Н – 414,2 кДж/моль.)
Координационная связь – частный случай ковалентной связи. Такая связь возникает, когда один их атомов имеет неподеленную электронную пару, а другой – вакантную орбиталь. У последнего до октета не хватает двух или более электронов. В этом случае происходит обобществление неподеленной пары электронов с образованием связи:
Н3N: + H+ → NH4+ (ион аммония).
Атом, обладающий неподеленной электронной парой и предоставляющий их для образования новой химической связи, называют донором, А который их принимает – акцептором. Поэтому, такую связь называют донорно-акцепторной.
Разновидностью координационной связи является семиполярная связь. Эта связь осуществляется также за счет неподеленной пары одного из атомов. Отдавая эту пару для образования связи, атом приобретает положительный заряд, а у другого атома, принявшего эту пару, появляется отрицательный заряд.
В результате новую связь можно рассматривать как одновременное проявление двух видов связи ковалентной (за счет обобществления электронной пары) и ионной за счет взаимодействия противоположных зарядов. Например:
(СН3)3 N: + O: → (CH3)3N+– O– или (СН3)3N→O
триметиламин оксид триметиламина
Водородная связь (Н-связь). Такая связь возникает между атомами, имеющими свободную электронную пару (например, кислород, азот, сера и др.), и водородом, который связан с другим атомом высокополярной ковалентной связью (например О–Н). В этом случае водород обладает достаточно высокой подвижностью, в результате чего возникает связь особого типа (Н-связь) энергия которой составляет всего 12,5 – 21 кДж/моль.
Водородная связь играет огромную роль в живой природе. Вода входящая в состав животных и растительных организмов, образует водородные связи, которые во много определяют их свойства.
Водородная связь образуется во многих системах, используемых в качестве строительных растворов и вяжущих материалов. Играет большую роль в процессах крашения, приготовлении некоторых полимерных материалов.
Лекция 3.
Типы органических реакций и их механизмы.
Органические реакции подчиняются в принципе тем же законам, что и неорганические, однако, в отличие от последних, органические реакции протекают с участием, как правило, молекул, а не ионов. Выход ожидаемого продукта при этом невысок (50 – 80%), поскольку часто идут побочные реакции. Поэтому органическую реакцию записывают в виде схемы, которая показывает исходные вещества и основной продукт реакции, а также условия проведения реакции, а вместо знака равенства чаще используют стрелку.
В органической химии чаще всего встречаются следующие типы органических реакций.
Реакции присоединения. В этом случае из двух (или нескольких) молекул
образуется одно новое вещество:
СН2=СН2 + Br2 → СН2Br–CH2Br
К реакциям присоединения можно отнести и реакции восстановления (присоединение атомов водорода). Эта реакция является обратной реакции окисления. Действие восстанавливающего реагента обозначается символом [H]:
[H]
Н3С – СО – СН3 → Н3С – СН – СН3
|
OH
Частным случаем восстановления является гидрирование.
Н2, Pt
СН2=СН2 → H3C – CH3
этан
Реакции замещения. В молекуле атом (или группа атомов) замещается другим атомом (или группой атомов), в результате чего образуются новые соединения:
СН4 + Cl2 → CH3Cl + HCl
Реакции отщепления (элиминирования). В результате такой реакции образуется новое вещество, содержащее кратную связь:
NaOH, спирт
СH3–CH2Br + NaOH → CH2=CH2 + NaBr + H2O
Реакции разложения. Эти реакции приводят к образованию новых веществ более простого строения в результате разложения исходного соединения на два и более.
O
// Pt
H—C → CO2 + H2
\
OH
Перегруппировки. При этом происходят внутримолекулярные перемещения атомов или групп атомов без изменения молекулярной формулы соединений, участвующих в реакции
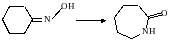
оксим циклогексанона капролактам
Реакции окисления. При окислении исходного соединения кислородом воздуха в присутствии катализатора или окислителями (действие окисляющего реагента обозначается в схеме реакции символом [O]) образуется новое вещество
[O]
СН3СН2ОН → CH3COH
этиловый спирт уксусный альдегид
Реакции полимеризации. В результате присоединения друг к другу большого числа простых веществ (мономеров) образуется вещество сложного строения с большей молекулярной массой (полимер):
nCH2=CH2 → [–CH2–CH2–]n
этилен полиэтилен
Реакции конденсации и поликонденсации. Образуется сложное вещество в результате соединения нескольких молекул (иногда большого числа), протекающего с отщеплением более простых веществ (воды, аммиака и др.):
НО–СН2–СН2– ОН + Н О–СН2–СН2–ОН → НО–СН2–СН2–О–СН2–СН2ОН–ОН
–Н2О
n HO–CH2–CH2–OH → [–CH2–CH2–O–]n + n H2O
Однако органические реакции удобнее классифицировать по механизмам. Под механизмом химической реакции понимают путь, который приводит к разрыву старой химической связи и образованию новой. Чтобы установить, как протекает этот процесс, необходимо представить все последовательные состояния, через которые проходит система «реагирующая молекула – реагент»
При этом необходимо учитывать образование не только конечных продуктов реакции, но и промежуточных частиц, а также влияние условий на протекание реакции. Рассмотрим реакцию замещения. Она сопровождается разрывом одинарных связей (σ-связей) и образованием новых с заменой одной атомной группировки на другую. В зависимости от характера реагентов и условий реакции разрыв σ- связи может протекать по двум основным механизмам.
1.Гетеролитический (ионный) механизм. Молекула А:В, состоящая из атомов А и В, под действием реагента С способна разрываться по двум направлениям – (1) и (2) с образованием ионов:
А| : В → А+ + :В– (1)
А : |В → В+ + :А– (2)
При этом электронная пара полностью переходит к одному из атомов (А или В). В зависимости от характера реагента (С+ или С–) и гетеролитического разрыва химической связи образуются различные продукты (молекулы или ионы)
(1) :А+ + : В– + С+ → А+ + В:С SE
(2) В+ + :А– + С+ → В+ + А:С
или
(1) А+ + :В– + :С– → В– + А:С SN
(2) В+ + :А– + :С– → :А– + В:С
Реагент С+ не располагает электронной парой, а использует ту пару электронов для вновь образующейся связи, которая принадлежит реагирующей молекуле А:В. Такой реагент называют электрофильным («имеющим сродство к электрону») или электроноакцепторным. К таким реагентам относятся катионы
Н+, Cl+, +NO2 , +SO3H, R+, RC+O
и молекулы со свободными орбиталями
АСl3, FeCl3, ZnCl2 и др.
Реакции, идущие с участием таких реагентов, называют электрофильными реакциями (замещения или присоединения). При этом субстрат (реагирующая молекула) проявляет нуклеофильные свойства.
Пример реакции электрофильного замещения (SE)
AlCl3
C6H6 + CH3Cl → C6H5CH3 + HCl
Реагент (:С–) располагает электронной парой для образования новой связи. Такой реагент называют нуклеофильным («имеющим сродство к ядру») или электронодонорным. К таким реагентам относятся анионы или молекулы, содержащие атомы с неподеленными электронными парами:
НО–, RO–, Cl–, RCOO–, CN–, R–, :NH2, H2O:, :NH3 и др.
Реакции, протекающие с участием таких реагентов, называют нуклеофильными реакциями (замещения присоединения отщепления). При этом реагирующая молекула проявляет электрофильные свойства.
Пример реакции нуклеофильного замещения
R– Cl + :OH– → R– OH + :Cl–
2. Гомолитический (радикальный) механизм.
Эти реакции идут в том случае, если атакующий реагент С – свободный радикал (частица с неспаренным электроном):
А ÷ В → А· + В·
А· + В· + С· → А:С + В·
А· + В· + С· → В:С + А· SR
Пример радикального замещения:
hυ
Cl2 → 2Cl·
CH4 + Cl· → ·CH3 + HCl
·CH3 + Cl:Cl → CH3Cl + Cl· и т.д.
По радикальному механизму могут протекать реакции замещения, присоединения или отщепления
Ионные реакции катализируются обычно кислотами или основаниями. Они зависят от природы растворителя и редко идут в газовой фазе.
Радикальные реакции инициируются светом, высокой температурой, или веществами, распадающимися на радикалы. Эти реакции обычно протекают в неполярных растворителях или в газовой фазе.
Взаимное влияние атомов в молекуле.
Взаимное влияние атомов в молекуле связано с перераспределением в ней электронной плотности. Это перераспределение может осуществляться при помощи двух эффектов – индуктивного эффекта и мезомерного эффекта (эффекта сопряжения).
В симметрично молекуле, состоящей из близких по электроотрицательности атомов (при условии нахождения молекулы в статическом состоянии), электронная плотность распределена равномерно (CH4, СCl4). Однако под действием реагента в такой молекуле может происходить частичное смещение электронного облака. Это влияние наиболее заметно в случае несимметричных молекул. Если атомы в молекуле отличаются по электроотрицательности значительно, то смещение электронной плотности происходит в сторону атома (или группы атомов) c с большей электроотрицательностью (СHCl3). В результате σ-связь поляризуется, оказывая влияние и на соседние связи.
Эффект, связанный со смещением электронной плотности по σ-связи под влиянием различных по электронной природе атомов или групп называют индуктивным эффектом (I). Этот эффект является наиболее простой формой проявления взаимного влияния атомов в молекуле. По мере удаления от атома (или группы атомов), вызывающего смещение электронной плотности, индуктивный эффект в насыщенных системах быстро ослабевает, например:
δδδ+ δδ+ δ+ δ–
СН3 → СН2 → СН2 → Cl
Если смещение электронной плотности происходит по цепи в сторону заместителя, (на себя, например, атома Cl), то такой эффект называют отрицательным (–I). Если смещение электронной плотности происходит в сторону цепи (от себя), то индуктивный эффект будет положительным (+I).
Типичный пример – увеличение кислотности уксусной кислоты при замене атома водорода метильной группы на галоген.
O
||
Cl ← CH2 ← C ← O ← H
В молекулах с сопряженными связями, содержащими электронодонорные и электроноакцепторные заместители, происходит смещение электронной плотности по π-системе. Это перемещение обусловлено взаимодействием π-электронов кратной связи с р- или π-электронами заместителя. Такой тип электронного влияния называют эффектом сопряжения (С) или мезомерным эффектом (М). Группы, смещающие π-электронную плотность в сторону системы проявляют +М эффект, оттягивающие электронную плотность на себя, обладают – М эффектом.
Перемещение электронной плотности в не реагирующей молекуле называют
статическим эффектом сопряжения. При взаимодействии молекулы, имеющей систему сопряженных связей, с атакующим реагентом происходит перераспределение электронной плотности в образующейся системе (переходное состояние или промежуточная частица). В этом случае говорят о динамическом эффекте сопряжения.
Органические ионы. Свободные радикалы.
При полном смещении электронной пары связи в сторону одного из атомов молекулы может произойти гетеролитический разрыв связи с образованием органических ионов. Например, для атома углерода возможны следующие превращения
| |
— C: | H → — C– + H+
| |
карбанион
| |
— C | :Cl → — C+ + Cl–
| |
карбкатион
В случае карбаниона атом углерода принимает один электрон, карбкатиона – теряет один электрон.
Присоединение атому углерода или отрыв от него двух электронов связаны с большой затратой энергии, поэтому получение высокозарядных углеродных ионов – процесс крайне маловероятный.
Органические ионы – активные заряженные частицы, время их жизни незначительно.
При гомолитическом разрыве связи пара электронов разъединяется с возникновение свободных радикалов. Свободные радикалы это молекулы или атомы, имеющие не спаренный (не поделенный) электрон на внешней оболочке, т.е. являются незаряженными частицами:
hυ
Сl2 → 2Cl·
Наличие свободной валентности, т.е. не спаренного электрона, придает свободным радикалам специфические свойства: высокую химическую активность, парамагнетизм (появление магнитного момента).
Чтобы получить свободные радикалы, необходимо затратить определенную энергию. Существует несколько способов их получения:
а) термические разложение (нагревание органических веществ до температуры 700 – 1000°С, иногда – значительно ниже), пример – разложение перекиси бензоила (80°С):
(С6Н5СОО)2 → 2С6Н5СОО· → 2С6Н5· ;
б) радиационное разложение под действие β– или γ– излучения:
Н2О → Н2О+ ·,
Н2О+ · + Н2О → Н3О + НО·.
Н2О+ · – катион-радикал, образующийся при отрыве электрона от молекулы воды под действием β-излучения.
Основные типы свободнорадикальных реакций.
Замещения
СН4 + Сl· → CH3· + HCl
Присоединения и распада
CH3· + CH2=CH2 ↔ CH3— CH2—CH2·
Изомеризации
СН3—СН3—СН2· → СН3—СН·—СН3
Рекомбинации
СН3· + СН3· → СН3 —СН3
Диспропорционирования
2R—CH2—CH2· → R—CH=CH2 + R—CH2—CH3
Время жизни свободных радикалов алифатического ряда очень небольшое. Например, полупериод существования радикала СН3· равен 0,006 с (сравни - время жизни атомарного водорода составляет 0,1 с). Именно поэтому они играют важную роль. С их участием протекают реакции галогенирования, нитрования, сульфирования, горения, взрыва, полимеризации и др.
Частицу, обладающую двумя не спаренными электронами, называют бирадикалом. Представляет интерес двухвалентный радикал метилен :СН2 (карбен) и его производные (карбены)
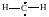 (I)
(I)
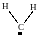 (II)
(II)
↑↑СН2 ↑↓ СН2
В триплетном состоянии (I) карбены проявляют свойства бирадикала, а в синглетном (II) они подобны ионам карбония с одной стороны, а с другой стороны – являются аналогами карбанионов. Основное состояние для метилена – триплетное.
Лекция 4.
Классификация органических соединений.
Все органические соединения в зависимости от строения углеродной цепи – скелета – делят на следующие группы.
1. Алициклические соединения – соединения с открытой незамкнутой цепью углеродных атомов (прямой или разветвленной)

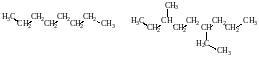
Такие соединения называются алифатическими соединениями или соединениями жирного ряда.
2. Циклические соединения – соединения, в которых углеродные атомы образуют циклы. Эти соединения делят на карбоциклические и гетероциклические.
А) Карбоциклические (изоциклические) – циклические соединения, образованные только углеродными атомами. В свою очередь карбоциклические соединения могут быть
а) алициклическими

Циклобутан Циклопентан Циклогексан
и б) ароматическими.
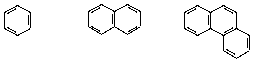
Бензол Нафталин Фенантрен
Б) Гетероциклические соединения – циклические соединения, в состав цепи которых входят и другие атомы – гетероатомы.
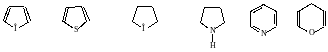
Фуран тиофен тетрагидрофуран пирролидин пиридин γ-пиран
Наиболее простыми представителями соединений ациклического, алициклического и ароматического рядов являются углеводороды, молекулы которых состоят только из двух элементов: С и Н. С этих соединений обычно начинают изучение органической химии.
При замене атомов водорода в углеводородах на другие атомы или группы атомов – функциональные группы – образуются многочисленные классы органических соединений.
Углеводороды R−H Сложные эфиры R−COOR
Галогенопроизводные R−Hal Нитросоединения R−NO2
Спирты R−OH Аминосоединения R−NH2
Альдегиды R−CHO Сульфокислоты R−SO3H
Кетоны R−CO−R Металлоорганические соединения
Кислоты R−COOH R−Me, R−Me−Hal
Простые эфиры R−O−R
Из этого ряда видно, что функциональная группа определяет класс соединения. Органические вещества, содержащие две или более различные функциональные группы, называются соединениями со смешанными функциями.
Каждый из этих классов делится в зависимости от характера связи между углеродными атомами на две группы: предельные и непредельные.
Номенклатура органических соединений
Тривиальная номенклатура
Это система исторически сложившихся названий, но применяемых до настоящего времени. Как правило, эти названия были даны еще в ранний период развития органической химии и никак не отражают строение органического вещества.
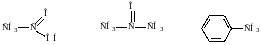
уксусная кислота ацетон толуол
Рациональная номенклатура
По правилам рациональной номенклатуры за основу названия органического соединения принимают название наиболее простого (чаще всего первого) члена данного гомологического ряда Все остальные соединения рассматриваются как его производные, образованные замещение в нем атомов водорода алкильными группами, атомами или функциональными группами. Названия алкильных и функциональных групп, наиболее часто встречающихся в структурных формулах органических молекул, приведены в таблице 1 и 2.
Таблица 1.
Названия некоторых алкильных групп
-
Структурная формула группы
Название
(краткое обозначение)
Структурная формула группы
Название
(краткое обозначение)
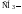
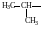
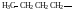
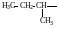
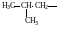
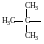
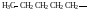
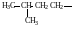
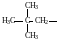
Метил (Ме)
Этил (Еt)
Пропил (Pr)
Изопропил (i-Pr)
Бутил (Bu)
втор-Бутил (s-Bu)
Изобутил (i-Bu)
трет-Бутил
Пентил (амил)
Изопентил (изоамил)
Неопетил
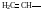
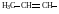
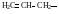
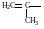
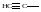
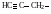
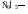
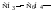
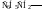
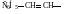
Винил, этинил
Пропенил
Аллил
Изопропенил
Этинил
Пропаргил
Фенил (Ph)
Толил (о-, м-, п-)
Бензил (Bn)
Стирил
Таблица 2.
Названия органических соединений некоторых классов
по рациональной номенклатуре
-
Класс
Соединение – основа названия
Примеры
Насыщенные углеводороды
Ненасыщенные углеводороды
Ацетиленовые углеводороды
Спирты
Альдегиды
Кислоты
СН4
метан
СН2=СН2
этилен
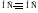
ацетилен
СН3ОН
карбинол
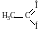
уксусный альдегид
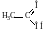
уксусная кислота
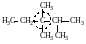
диметилэтилизопропилметан
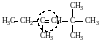
α-метил-α-этил-β-трет-бутилэтилен
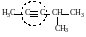
метилизопропилацетилен
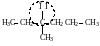
метилэтилпропилкарбинол
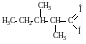
метил-втор-бутилуксусный альдегид
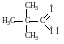
триметилуксусная кислота
Систематическая номенклатура ИЮПАК
Для того чтобы назвать органическое соединение по систематической номенклатуре ИЮПАК, нужно:
выбрать родоначальную структуру;
выявить все имеющиеся в соединении функциональные группы;
выбрать, какая группа является старшей (таблица 3); название этой группы отражается в названии соединения в виде суффикса и его ставят в конце названия соединения; все остальные группы дают в названии в виде префиксов (приставок);
обозначить ненасыщенность соответствующим суффиксом (-ен или -ин), а также префиксом (дегидро-, тетрагидро- и др.);
пронумеровать главную цепь, придавая старшей группе наименьший из номеров;
перечислить префиксы (приставки) в алфавитном порядке (при этом умножающие префиксы ди-, три- и т.д. не учитываются);
составить полное название соединения
Таблица 3
Наиболее важные функциональные группы, которые могут быть представлены в названиях органических соединений префиксами и суффиксами
(приведены в порядке убывания старшинства)
Название класса |
Формула группы |
Название группы в виде префикса |
Название группы в виде суффикса |
Катионы
Карбоновые кислоты
Сульфокислоты Производные кислот: ангидриды сложные эфиры галогенангидриды амиды нитрилы
Альдегиды
Кетоны
Спирты Тиолы Амины Имины Простые эфиры Сульфиды Галогенпроизводные Нитрозопроизводные Нитропроизводные
|
|
онио-
карбокси-
сульфо-
− алкоксикарбонил- хлорформил- карбамоил- циан-
формил-
оксо-
гидрокси- меркапто- амино- имино- алкокси- алкилтио- галоген- нитрозо- нитро-
|
-оний
-овая кислота (карбоновая кислота) -сульфонокая
-ангидрид -оат -оилхлорид -амид -нитрил
-аль
-он
-ол -тиол -амин -имин -оксид (эфир) -сульфид -галогенид − −
|
Родоначальная структура – главная цепь а ациклической молекуле или гетероциклическая система (или ее часть), лежащая в основе соединения.
В ациклических соединениях главной цепью называют цепь углеродных атомов, составляющую основу названия и нумерации. В состав этой цепи обязательно должна входить старшая характеристическая группа. Главная цепь должна содержать наибольшее число заместителей, максимальное число кратных (двойных и тройных) связей и должна быть наиболее длинной.
Главную цепь нумеруют в соответствии с наименьшей суммой цифровых индексов, указывающих положения заместителей и кратных связей.
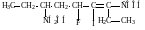
7-гидрокси-3-иод-4-фтор-2,6-диэтил-2-гептеновая кислота
(в этой нумерации в главную цепь включены старшая группа СООН и один из заместителей - ОН)
В случае кратных связей при одинаковых цифровых индексах двойных и тройных связей предпочтение отдается двойной связи.
1,3-гексадиен-5-ин
В алициклических соединениях главной цепью считают замкнутую цепь углеродных атомов в названии этой цепи применяют префикс цикло-.

циклобутан циклогексан
В основе названий ароматических соединений лежат тривиальные названия.
бензол нафталин
В гетероциклических соединения за основу берут название соответствующего гетероцикла.

При выборе старшей группы важно старшинство заместителей относительно друг друга.

старшая старшая
группа группа
3-гидроксипропановая кислота 3-нитро-1-пропанол
После того как определена родоначальная структура, выбрана старшая группа (обозначается суффиксом), проведена нумерация, выявлены другие группы, составляют полное название. При этом цифровые индексы (локанты), указывающие положение заместителей и кратных связей, дают перед префиксом и перед суффиксом.
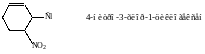
Углеводороды алифатического ряда.
Все алифатические углеводороды можно разделить по характеру связей между атомами углерода на две большие группы: предельные (насыщенные) и непредельные (ненасыщенные) углеводороды.
Насыщенные углеводороды (алканы, парафины).
Строение алканов. Гомологический ряд. Радикалы. Простейшим представителем предельных углеводородов является метан СН4. Атом углерода имеет sp3-гибридизацию, угол между связями 109° 28’. Заменяя атом водорода на метильную группу можно получить структурную формулу следующего за метаном углеводорода – этана С2Н6.
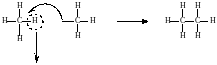
Добавляя следующую метильную группу, получим следующий за метаном углеводород – пропан С3Н8.
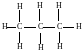
Таким образом, можно вывести формулы остальных представителей предельных углеводородов. Все предельные углеводороды объединяют в ряд в соответствии с ростом числа атомов углерода цепи, причем по составу углеводороды отличаются по составу на группу СН2, называемую гомологической разностью. Общая формула гомологического ряда предельных углеводородов имеет вид СnН2n +2.
Если углеводород лишается одного или нескольких атомов водорода, то образуется структура называется углеводородным радикалом. (метил, метилен, метин). Если свободная валентность находится у атома углерода, соединенного с тремя атомами водорода это метильный радикал, с двумя атомами водорода и одним углерода то это первичный радикал. Если у атома углерода одна связь с водородом, а две с углеродом, то это вторичный радикал. Если свободная валентность находится у атома углерода, соединенного с тремя атомами углерода, то это третичный радикал. Название радикала получают заменой окончания ан в названии углеводорода на ил (например этан – этил , бутан – бутил и.т.д.).
Номенклатура и изомерия.
Для названия углеводородов используют в основном номенклатуру IUPAC.
Общее название углеводородов – алканы.
В молекуле углеводорода выбирают наиболее длинную цепь.
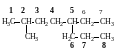
2. Цепь нумеруют таким образом, чтобы сумма номеров заместителей была минимальна. Если в цепи несколько одинаковых заместителей, то перечисляются номера заместителей, а затем греческими числительными указывают число одинаковых заместителей.
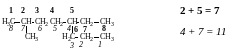
3. Если в качестве основной цепи можно выбрать несколько разных с одинаковой длиной, то из них выбирают такую цепь, которая имеет максимальное число заместителей.
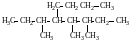
3,4,5-триметил-4-бутилоктан, а не 3-метил-4-(1’,2’-диметилбутил)октан
Изомерия. Для алканов характерна структурная изомерия. Изомеры – это соединения, имеющие одинаковый состав, но разное химическое строение.
При названии разветвленных углеводородов часто используют приставку изо-. Например: н-бутан и изо-бутан.

В первом случае все четыре связи образуют прямую (нормальную) цепь, а втором случае – разветвленную (изостроение). Необходимо отметить, что в углеводородах даже с прямой цепью атомы углерода располагаются не по прямой, а имеют зигзагообразную форму с межвалентными углами 109о 28’. Соединения с прямой цепью называют нормальными (обозначают буквой н-), а с разветвленной (приставка изо-).
При выводе структурных формул отдельных изомеров можно поступать следующим образом.
1. В соотвествии с числом углеродных атомов в молекуле записывают прямую углеродную цепь (углеродный скелет). Например С5Н12 состоит из пяти атомов углерода:
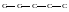
1 2 3 4 5
2. «Отщепляя» крайние углеродные атомы располагают их у оставшихся в цепи, добиваясь максимально возможного числа перестановок. При этом первоначальная углеродная цепь укорачивается, структура становится более разветвленной.
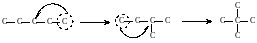
Необходимо помнить, что «изогнув» произвольно молекулу, нельзя получить новый изомер. Например:
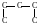
3. Соблюдая условия четырехвалентности углеродных атомов, заполняют оставшиеся валентности атомами водорода.
Чем больше в молекуле атомов углерода, тем больше изомеров. В зависимости от положения в углеродной цепи атом углерода может быть первичным (если углерод затрачивает одну валентность на связь с другим углеродным атомом), вторичным (если соединен с двумя другими углеродными атомами), третичным (связан с тремя другими атомами углерода), четвертичным (связан с четырьмя другими углеродными атомами).
Здесь первичные атомы углерода заключены в кружок, вторичный атом – в квадрат, третичный – в треугольник, четвертичный – в пунктирный кружок.
Лекция 5
Способы получения алканов.
Природные источники. Для получения предельных углеводородов используют в основном природные источники (газ, нефть, уголь, древесину, торф, и др.) и синтетические методы. Например, метан, этан, пропан и другие находятся в природном газе или растворены в нефти. Метан образуется при действии анаэробных (развивающихся без доступа воздуха) микробов на различные органические остатки (например, целлюлозу):
(С6Н10О5)n + nН2О → 3nCO2 + 3nСН4
Алканы можно получать гидрированием углей, сухой перегонкой углей, древесины, торфа (нагревание без доступа воздуха), перегонкой нефти.
Синтетические методы.
1. Гидрирование непредельных углеводородов (этилен, ацетилен) в присутствии катализатора.
С2Н4 + Н2 → С2Н6
2. Синтез Вюрца (1870). Метод позволяет получать симметричные алканы с большим содержанием атомов углерода.
СН3 – I + Na + I – CH3 → CH3 – CH3 + 2NaI
Если в реакции используется два галогеналкила (СН3I и C2H5I), то образуется не один продукт, а смесь (СН3 – СН3, С2Н5 – С2Н5, СН3 – С2Н5).
3. Синтезы на основе Mg органических соединений.
R1Br + Mg → R1MgBr
R1MgBr + R2Br → R1 – R2 + MgBr2
4. Щелочное плавление карбоновых кислот.
СН3 – СООNa + NaOH → СН4 + Na2CO3
Физические свойства. Первые четыре члена гомологического ряда – газы, С5 – С15 – жидкие, С16 и выше – твердые. Алканы легче воды и в ней практически не растворяются, но растворяются в большинстве органических растворителей. Жидкие алканы – хорошие растворители для многих органических веществ. Температуры кипения и плавления приводятся в справочниках и учебниках (Артеменко, 2000, стр. 56.)
Химические свойства. В молекулах углеводородов все атомы связаны прочными σ-связями, валентности углеродных атомов полностью насыщены водородом. Потому предельные углеводороды проявляют высокую химическую инертность: не вступают в реакции присоединения, не взаимодействуют с ионными реагентами (кислотами и щелочами), окислителями, активными металлами.
Основные превращения предельных углеводородов идут только при воздействии высокой энергии (нагревание, УФ-облучение). При этом может произойти разрыв связи С – Н с заменой водорода на другой атом или группу атомов, или разрыв связи С – С. Хотя энергия связи С – Н больше энергии связи С – С, разрыв идет преимущественно по связи С – Н, поскольку эти связи более доступны для атаки химическими реагентами.
Связи С – С и С – Н, обладают незначительной полярностью, поэтому при разрыве образуют в основном не ионы, а радикалы, т.е. разрыв протекает по гомолитическому механизму. Таким образом, для предельных углеводородов характерны два основных типа реакций:
реакции замещения водорода с разрывом С – Н связи;
реакции расщепления молекулы с разрывом как С – Н, так и С – С связей.
Реакции замещения. В этих реакциях легче всего происходит замещение атома водорода, связанного с третичным атомом, труднее – со вторичным. Это объясняется величинами энергий связей С – Н у первичного (около 420 кДж/моль), вторичного (390 кДж/моль) и третичного (370 кДж/моль).
Основные реакции замещения предельных углеводородов.
Галогенирование. Реакция идет при облучении или нагревании.
СН4 + Cl2 → CH3Cl + HCl.
Реакция протекает по цепному радикальному механизму, включающему стадии инициирования, роста и обрыва цепи.
2. Нитрование по Коновалову (12 – 14% р-р НNO3, 140 °С).
СН3 – СН2 – СН2 – СН3 + HNO3 → CH3 – CH NO2 – CH2 – CH3
2-нитробутан
Механизм цепной радикальный.
3. Сульфохлорирование и сульфоокисление (Рид и Хорн 1936).
R – H + SO2 + Cl2 → R – SO2Cl + HCl
Алкилсульфохлорид
Механизм цепной радикальный, катализатор hυ, перекиси.
R – H + Cl˙ → R˙ + HCl
Cl2 (рост цепи)
R˙ + SO2 → R – SO2˙ ―→ R – SO2Cl + Cl˙
Этим методом получают сульфокислоты с 12 – 18 атомами углерода и выше, применяемые для получения ПАВ (R – SO3 Na).
Реакции расщепления
1. Отщепление водорода (дегидрирование). Реакция протекает в присутствии катализатора (Cr2O3) при нагревании с образованием непредельных углеводородов.
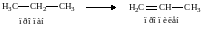
2. Реакции расщепления молекулы алкана за счет разрыва С – С связи.
Эти реакции протекают при крекинге нефти и окислении алканов.
Реакции изомеризации. При нагревании алканов с числом атомов углерода не менее четырех в присутствии катализатора (АlCl3) происходит превращение неразветвленной цепи в разветвленную
Непредельные (ненасыщенные) углеводороды.
Алкены.
Алкенами или олефинами называют углеводороды, в молекулах которых между углеродными атомами имеется двойная связь. Алкены образуют гомологический ряд с общей формулой СnH2n. Простейшим представителем этого ряда является этилен.
Электронное строение и характер гибридизации двойной связи были рассмотрены ранее.
Номенклатура Согласно номенклатуре IUPAC названия алкенов производят из названий соответствующих алканов заменой суффкса ан на ен.
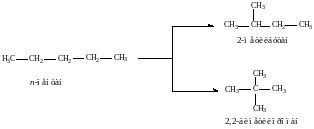
Например: алкан – алкен. Главная цепь должна обязательно содержать двойную связь. Цепь нумеруют таким образом, чтобы номер первого углеродного атома при двойной связи был минимальным. Цифру, обозначающую положение двойной связи, ставят перед названием основной цепи. В отечественной литературе (например, учебник Артеменко) согласно систематической номенклатуре ставят после названия цепи. В остальном порядок составления названия такой же как для алканов, соответствует правилам IUPAC
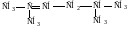
2,5-диметилгексен-2 или 2,5-димети-2-гексен
Алканы простого строения часто называют, заменяя суффикс ан на илен: этан – этилен, пропан – пропилен.
Изомерия. Для алкенов кроме изомерии углеродного скелета, характерна изомерия положения двойной связи, а также изомерия, связанная с невозможностью вращения вокруг двойной связи без ее разрыва. Это приводит к появлению геометрических изомеров или цис- транс-изомеров. Геометрическая изомерия является одним из видов пространственной изомерии.
Изомеры, у которых заместители расположены по одну сторону от двойной связи, называются цис-изомерами, а по разные стороны – транс-изомерами. Цис- и транс-изомеры отличаются не только пространственным строением, но и многими физическими и химическими свойствами.
цис-бутен-2 транс-бутен-2
Способы получения алкенов
1. Крекинг нефти – термическая обработка нефти и нефтепродуктов.
2. Дегидрогенизация алканов в присутствии катализаторов при 560 – 620 °С.
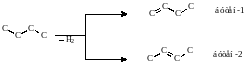
Дегидратация спиртов в присутствии кислотных катализаторов Н2SO4, H3PO4, Al2O3 и др.
140°C, кат. 160-170°C
СН3СН2ОН + Н2SO4 → СН3СН2О-SO2-OH → CH2=CH2
-H2O -H2SO4
При дегидратации спиртов атом водорода отщепляется от наименее гидрогенизированного атома углерода, т.е. вторичного или третичного (правило Зайцева)
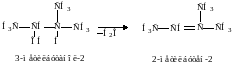
4. Дегидрогалогенирование алкилгалогенидов под действием спиртового или твердого КОН.
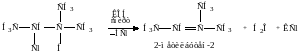
Отщепление НСl проходит по правилу Зайцева. Механизм таких реакций, называемых реакциями отщепления, рассмотрим позднее. Здесь отметим, что чем устойчивей алкен, тем легче он образуется. Наиболее замещенные алкены наиболее устойчивы.
5. Дегалогенирование дигалогенпроизводных с атомами галогена у соседних атомов углерода под действием Zn пыли в спирте.
R – CHCl – CH2Cl + Zn → R – CH2 = CH2 + ZnCl2
6. Селективное гидрирование в присутствие катализатора
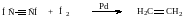
Физические свойства (Самостоятельно Артеменко)