
1) Не реагирует с водой – т.К. Кремниевая кислота нерастворима.
2) При сплавлении реагирует со щелочами: SiO2 + 2KOH -tàK2SiO3 + H2O
3) Реагирует с основными оксидами: SiO2 + MgО -tàMgSiO3 и карбонатами щелочных металлов: SiO2 + K2CO3 -tà K2SiO3 + CO2 при сплавлении.
4) Из кислот растворяется только в плавиковой: SiO2 + 6HF = H2[SiF6] + 2H2O
5) При температуре выше 1000 °С реагирует с активными металлами, при этом образуется кремний: SiO2 + 2Mg = Si + 2MgO
или при избытке восстановителя – силициды: SiO2 + 4Mg = Mg2Si + 2MgO.
6) Взаимодействие с неметаллами.
Реагирует с водородом: SiO2 + 2Н2 = Si + 2Н2O,
Взаимодействует с углеродом: SiO2 + 3С = SiС + 2СO.
Кремниевая кислота.
Имеет полимерное строение и состав xSiO2 • yH2O. В водных растворах доказано существование ортокремниевой H4SiO4, метакремниевой H2SiO3 кислот.
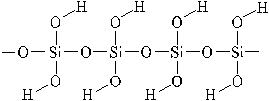
Получение: только косвенным путём, из солей: Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
Na2SiO3 + 2Н2O + 2CO2 = 2NaHCO3 + H2SiO3↓,
Свойства: 1)Растворяются в концентрированных щелочах: H4SiO4 +4KOH K4SiO4 + 4H2O
2)Разлагаются при нагревании: H2SiO3 -tàSiO2 + H2O
Силикаты.
Большинство нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом». Их водные растворы — это хорошо известный силикатный клей.
Получение: 1) растворение кремния, кремниевой кислоты или оксида в щелочи:
H4SiO4 + 4KOH K4SiO4 + 4H2O
Si + 2NaOH + H2O = Na2SiO3 + H2
SiO2 + 2KOH -tàK2SiO3 + H2O
2) Сплавление оксидов: СаО + SiO2 -tà CaSiO3
3) Сплавлением диоксида кремния с карбонатами: SiO2 + СаС03 = СаSiO3 + С02
4) Взаимодействие солей: K2SiO3 + CaCl2 = CaSiO3 + 2KCl
Из растворов силикатов действием на них более сильных кислот — соляной, серной, уксусной и даже угольной получается кремниевая кислота Н2SiO3: К2SiO3 + 2НСl = 2КСl + Н2SiO3 Следовательно, Н2SiO3 очень слабая кислота. Она нерастворима в воде и выпадает из реакционной смеси в виде студенистого осадка, иногда заполняющего компактно весь объем раствора, превращая его в полутвердую массу, похожую на студень, желе. При высыхании этой массы образуется высокопористое вещество — силикагелъ, широко применяемый в качестве адсорбента — поглотителя других веществ.
Применение кремния и его соединений.
Кремний используется в электронике для изготовления полупроводниковых приборов. Диоксид кремния применяется для производства стекла, керамики, бетонных изделий и кирпича. Чистый кварц используется в приборостроении.
При сплавлении кварцевого песка с углем при высоких температурах образуется карбид кремния SiC, который по твердости уступает только алмазу. Поэтому его используют для затачивания резцов металлорежущих станков и шлифовки драгоценных камней. Из расплавленного кварца изготавливают различную кварцевую химическую посуду, которая может выдерживать высокую температуру и не трескается при резком охлаждении. Соединения кремния служат основой для производства стекла и цемента. Стекло – тоже силикат.
Состав обычного оконного стекла: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2: 6SiO2 + Na2CO3 + CaCO3 = Na2O·CaO·6SiO2 + 2CO2.
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb2+ – хрусталь; Cr3+ – имеет зеленую окраску, Fe3+ – коричневое бутылочное стекло, Co2+ – дает синий цвет, Mn2+ – красновато–лиловый
Отличительная особенность стекла — способность размягчаться и в расплавленном состоянии принимать любую форму, которая сохраняется при застывании стекла. На этом основано производство посуды и других изделий из стекла.
Стекло — одно из древнейших изобретений человечества. Уже 3—4 тыс. лет назад производство стекла было развито в Египте, Сирии, Финикии и Причерноморье. Высокого совершенства в стеклоделии достигли мастера Древнего Рима. Они умели получить цветные стекла и делать из кусочков такого стекла мозаики. Стекло — это материал не только ремесленников, но и художников. Произведения искусства из стекла являются обязательными атрибутами любого крупного музея. А цветные витражи церквей, мозаичные панно — яркие тому примеры. В одном из помещений Санкт-Петербургского отделения Российской Академии наук находится мозаичный портрет Петра I, выполненный М. В. Ломоносовым. Области применения стекла очень обширны. Это оконное, бутылочное, ламповое, зеркальное стекло; стекло оптическое — от стекол очков до стекол фотокамер; линзы бесчисленных оптических приборов — от микроскопов до телескопов. Другой важный материал, получаемый на основе соединения кремния, — цемент. Его получают спеканием глины и известняка в специальных вращающихся печах. Если порошок цемента смешать с водой, то образуется цементное тесто, или, как его называют строители, «раствор», который постепенно затвердевает. При добавлении к цементу песка или щебня в качестве наполнителя получают бетон. Прочность бетона возрастает, если в него вводится железный каркас, — получается железобетон, из которого готовят стеновые панели, блоки перекрытий, фермы мостов и т. д. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс и изделия из них. Открытие кремния. Хотя уже в глубокой древности люди широко использовали в своем быту соединения кремния, сам кремний в элементарном состоянии был впервые получен в 1825 г. шведским химиком Й. Я. Берцелиусом. Однако за 12 лет до него кремний получили Ж. Гей-Люссак и Л. Тенар, но он был очень загрязнен примесями. Латинское название силициум берет свое начало от лат. силекс — кремень. Русское название «кремний» происходит от греч. кремнос — утес, скала.
