
- •8. Гетерогенные равновесия в аналитической химии. Способы выражения
- •16. Адсорбционная хроматография. Тонкослойная хроматография (тсх).
- •24. Количественный анализ. Классификация методов количественного
- •Типы титрования
- •2)Методы гравиметрии
- •Методы гравиметрии Метод осаждения
- •Метод выделения
- •Метод отгонки
- •3) Волюмометрический метод
- •Физические и физико-химические (инструментальные) методы анализа
- •Окислительно-восстановительное титрование
- •Осадительное титрование
- •Комплексометрическое титрование
- •Комплексонометрическое титрование
- •56. Оптические методы анализа. Общий принцип метода. Классификация
- •Оптические методы анализа
- •74. Кулонометрический анализ. Принципы метода. Прямая кулонометрия.
Осадительное титрование
Осадительное титрование основано на реакциях осаждения, которые могут протекать с достаточной скоростью при невысоких температурах и являются необратимыми. Хотя таких реакций достаточно много, для анализа оказались пригодными лишь несколько. Хорошо разработан метод осадительного титрования нитратом серебра AgNO3 – аргентометрия. В качестве индикаторов при аргентометрическом анализе применяют K2CrO4, FeCl3, адсорбционные индикаторы. Ион серебра образует достаточно большое количество нерастворимых в воде солей, что обусловливает его аналитические возможности; аргентометрией можно определять Cl-, Br-, I-, SCN-, AsO43-, CO32- и др. Однако широкому использованию метода мешает высокая стоимость нитрата серебра. Еще реже используется метод меркуриметрии, в котором титрантами служат очень ядовитые соли ртути.
Комплексометрическое титрование
При комплексометрическом титровании в качестве титрантов используют вещества, способные образовывать прочные комплексы с анализируемым веществом. Наибольшее распространение в аналитической практике получила этилендиаминтетрауксусная кислота – ЭДТА – (НООС - СН2)2 – N- CH2 – CH2 – N – (CH2 – COOH)2 и ее натриевая соль - трилон Б. Этот титрант применяется, прежде всего, для количественного определения катионов металлов (Fe3+, Cr3+, Ca2+, Mg2+ и др.). Молекула ЭДТА реагирует всегда с 1 катионом металлом, т.е. фактор эквивалентности равен 1. В качестве индикаторов часто применяют эриохром черный Т, мурексид и некоторые другие органические вещества. Очень сильное влияние на результаты комплексометрического титрования оказывает рН среды, поэтому чаще всего анализ проводят в среде буферного раствора.
Комплексонометрическое титрование
\Комплексонами обычно называют группу полиаминополикарбоновых кислот. Хотя число различных комплексонов очень велико, под термином «комплексонометрия» или «хелатометрия» обычно имеются в виду реакции титрования солями этилендиаминтетрауксусной кислоты (ЭДТА), чаще всего двухзамещенной натриевой солью Na2H2Y2H2O, широко известной под торговым названием трилон Б
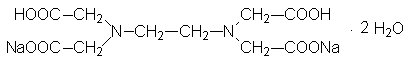
Символом Y (или Y4-) обозначают четырехзарядный анион этилендиаминтетрауксусной кислоты (ООСCH2)2NCH2CH2N(CH2COO)24-. Сокращением ЭДТА обычно обозначают анион H2Y2-, входящий в состав трилона Б.
Реакции взаимодействия различных катионов с ЭДТА в растворе протекают по уравнениям:
Ca2+ + H2Y2- = CaY2- + 2H+,
Bi3+ + H2Y2- = BiY- + 2H+,
Zr4+ + H2Y2- = ZrY + 2H+.
Таким образом, независимо от заряда катиона, в реакции комплексообразования принимает участие один катион и один анион. Поэтомумолярные массы эквивалента титранта и определяемого катиона равны их молярным массам (fэ=1).
Уравнения приведенных выше реакций показывают, что степень их протекания зависит от pH раствора. Влияние кислотности раствора особенно заметно при титровании катионов, образующих сравнительно малоустойчивые комплексы (Mg2+, Ca2+ и др.): их можно оттитровать лишь в щелочной среде. Многие катионы титруются в аммиачном буферном растворе.
ПРЯМОЕ ТИТРОВАНИЕ
К измеренному пипеткой объему анализируемого раствора, находящегося в конической колбе, постепенно прибавляют из бюретки (рис., 2) титрованный (т. е. с известной концентрацией) раствор реактива. Титрование заканчивают, когда анализируемое вещество полностью прореагирует с добавляемым реактивом. Конец титрования устанавливают по изменению окраски соответствующего индикатора (см.) или другими способами. По шкале бюретки определяют объем раствора реагента, пошедшего на титрование. Нормальную концентрацию С1 и титр Т раствора анализируемого вещества (см. Концентрация) вычисляют по формулам:
![]() где
υ2 и
С2 —
объем и нормальная концентрация раствора
реактива соответственно, а Э — эквивалентный
вес (см.)
анализируемого вещества. Такой метод
титрования называют
прямым титрованием.
где
υ2 и
С2 —
объем и нормальная концентрация раствора
реактива соответственно, а Э — эквивалентный
вес (см.)
анализируемого вещества. Такой метод
титрования называют
прямым титрованием.
ОБРАТНОЕ ТИТРОВАНИЕ
Иногда
необходимо применять обратное
титрование.
В этом случае к объему v1 анализируемого
раствора прибавляют избыточный точно
измеренный объем соответствующего
раствора реагента (реактив I). Не вступивший
в реакцию избыток этого реагента титруют
раствором другого реагента (реактив
II). Нормальную концентрацию С1 и титр Т
раствора анализируемого вещества
вычисляют по формулам:![]() где
υ2,
υ3 и
С2,
С3 —
объемы титрованных растворов реагентов
I и II и их нормальные концентрации
соответственно.
где
υ2,
υ3 и
С2,
С3 —
объемы титрованных растворов реагентов
I и II и их нормальные концентрации
соответственно.
КОСВЕННОЕ ТИТРОВАНИЕ
Третьим основным видом титриметрических определений является титрование заместителя (титрование по замещению, косвенное титрование). В этом методе к определяемому веществу добавляют специальный реагент, вступающий с ним в реакцию. Один из продуктов взаимодействия затем оттитровывают рабочим раствором. Например, при иодометрическом определении меди к анализируемому раствору добавляют заведомый избытокKI. Происходит реакция
2Cu2+ + 4I- → 2CuI + I2.
Выделившийся иод оттитровывают тиосульфатом натрия.
СПОСОБЫ ОПРЕДЕЛЕНИЯ ОТДЕЛЬНЫХ НАВЕСОК И АЛИКВОТНЫХ ЧАСТЕЙ
При титриметрических определениях проводят несколько параллельных титрований пробы. При этом используют два метода: метод отдельных навесок и метод пипетирования.
Метод отдельных навесок: на аналитических весах берут 2–3 навески анализируемого вещества, каждую навеску растворяют в небольшом количестве воды и каждый полученный раствор титруют рабочим раствором.
Метод пипетирования: навеску анализируемого вещества растворяют в мерной колбе и на титрование отбирают равные порции раствора измерительной пипеткой (аликвотные части). При расчетах учитывают вместимость мерной колбы и аликвотной части.
Методы установления конечной точки титрования /визуальные, инструментальные/.
Конечную точку титрования определяют различными способами, например визуально, наблюдая за изменением окраски раствора (титрование с индикатором), за появлением осадка (осадительное титрование) или измеряя потенциал индикаторного электрода.
В некоторых редких случаях титрант или титрующий раствор имеют окраску. Окраска того или иного химического вещества до и после химической реакции титрования неодинакова. Например, часто применяемый в качестве титрующего вещества перман-ганат калия имеет яркую красно-фиолетовую окраску. В результате реакции титрования он обесцвечивается. Даже очень небольшой избыток перманганата калия окрашивает титруемый раствор после прохождения конечной точки в заметный красный цвет.
Почти всегда необходима индикация конечной точки. Цветные индикаторы представляют собой красители, которые изменяют свой цвет при прохождении рН через конечную точку. Их добавляют в титруемый раствор в небольших количествах. Эти индикаторы являются кислотно-основными или окислительно-восстановительными корреспондирующими системами, обе формы которых различно окрашены. Комплексообразующие красящие вещества в комплексной и свободной формах тоже имеют различные цвета.
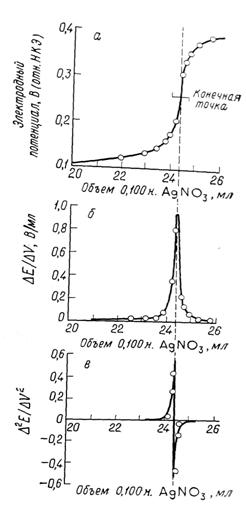
Потенциометрический метод часто применяют для выявления конечной точки титрования. Концентрация одного из ионов, принимающих участие в реакции титрования, преобразуется ионоселективным электродом (см. раздел 1.7) в электрический потенциал (рН, окислительно-восстановительный потенциал, потенциал иона металла или аниона). Изменение потенциала, показанное ранее на кривых титрования (см. рис. 1—109), дает хорошо различимую конечную точку. После определения точки перегиба по оси абсцисс на которой нанесены единицы объема, отсчитывают количество титрующего реагента, эквивалентное количеству титранта. Двухступенчатые кривые расшифровывают аналогично для обоих титруемых веществ. Такая возможность является существенным преимуществом потенциометрического определения конечной точки.
Способ кондуктометрии (измерения электролитической проводимости) тоже иногда используют для индикации конечной точки титрования. По мере совершенствования потенциометрических методов, в том числе и с питаемыми током электродами, кондуктометрический способ в значительной мере потерял свое значение в титрометрии. Способ основан на том, что во время титрования в результате химической реакции ионы связываются или образуются новые. В итоге происходит характерное изменение электрической проводимости. Графически оно выражается в изломе кривой в конечной точке титрования. Измерение осложняется присутствием посторонних электролитов, которые не принимают участия в реакции, но обеспечивают проводимость. Относительные изменения проводимости при титровании из-за этого уменьшаются, так что требуются более чувствительные методы для его измерения.
