
- •Рецензенты:
- •Введение
- •1. Классификация спектроскопических методов
- •2. Природа атомных и молекулярных спектров
- •2.1. Основы теории атомных спектров
- •2.1.1. Основные положения
- •2.1.2. Серийная структура линий атомных спектров
- •2.1.3. Многоэлектронные системы с одним или несколькими валентными электронами
- •Для атома натрия.
- •2.1.4. Особенности атомных спектров
- •2.2. Основы теории молекулярных спектров
- •2.2.1.Вращательные и колебательные спектры молекул
- •2.2.2. Электронные спектры молекул
- •2.2.3. Влияние различных факторов на положение и интенсивность полос в электронном спектре
- •3. Основные способы количественных определений спектроскопическими методами
- •4. Методы атомной спектроскопии
- •4.1. Атомно-эмиссионная спектроскопия
- •4.1.1. Процессы возбуждения эмиссионного атомного спектра
- •4.1.2. Интенсивность излучения спектральных линий
- •4.1.3. Основы количественного спектрального анализа
- •4.1.4. Аппаратура
- •Источники света
- •Монохроматор
- •Приемники излучения
- •4.1.5. Практические работы
- •Контрольные вопросы
- •4.2. Атомно-эмиссионная фотометрия пламени
- •4.2.1. Аппаратура
- •1 − Анализируемый раствор; 2 − распылитель; 3 − слив; 4 − рефлектор;
- •5 − Горелка; 6 − диафрагма; 7, 8 − конденсоры; 9 − интерференционный светофильтр; 10 − линза; 11 − защитное стекло; 12 − фотоэлемент;
- •13 − Усилитель;
- •1 − Катод; 2 − эмиттер;
- •3 − Анод
- •4.2.2. Пламенный источник атомизации и возбуждения
- •4.2.3. Факторы, влияющие на результаты пламенно-фотометрических определений
- •4.2.4. Порядок проведения анализа методом эмиссионной фотометрии пламени на спектрометре
- •4.2.5. Практические работы
- •Контрольные вопросы
- •4.3. Атомно-абсорбционная спектрофотометрия
- •4.3.1. Теоретические основы метода
- •4.3.2. Аппаратура
- •4.3.3. Основы количественного анализа
- •4.3.4. Практическое применение
- •4.3.5. Порядок проведения атомно-абсорбционного анализа на спектрометре «SolAAr s2»
- •4.3.6. Практические работы
- •Контрольные вопросы
- •5. Молекулярная абсорбционная спектрофотометрия
- •5.1. Общая характеристика метода
- •5.2. Основной закон светопоглощения
- •5.3. Молярный коэффициент поглощения
- •5.4. Выбор оптимальных условий фотометрического определения
- •5.5. Аппаратура и техника фотометрических измерений
- •5.6. Практические работы
- •6. Задачи по спектроскопическим методам анализа
- •6.1. Решение типовых задач
- •6. 2. Задачи для самостоятельного решения
- •Литература
2.2.2. Электронные спектры молекул
Поглощение молекулой квантов УФ-видимой области электромагнитного излучения приводит к возбуждению валентных электронов, находящихся в различных состояниях (n-, σ-, π-электронов в органических соединениях и d-, f-электронов в ионах металлов), а также к электронным переходам с переносом заряда (в комплексных соединениях).
В соответствии с методом молекулярных орбиталей (МО), основанном на квантово-механических представлениях, электроны в молекуле находятся на связывающих, несвязывающих и разрыхляющих орбиталях.
Для молекулярных электронных переходов так же, как и для атомных, справедливы определенные правила отбора. Они связаны с изменением спинового состояния, симметрии молекулярных орбиталей, колебательных квантовых чисел и другими факторами. Расположение энергетических уровней, которые соответствуют разным МО, а также возможные переходы n-, σ- и π- электронов изображены на рис. 2.4.
Н
Рис. 2.4. Схема
электронных уровней и переходы в
молекуле с участием
n-,
σ-
и π-
электронов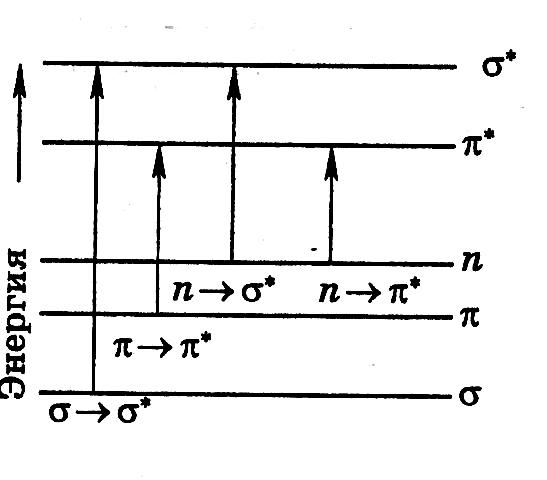 аибольшей
энергии требуют σ→σ*
переходы, связанные с возбуждением
внутренних электронов. Они соответствуют
поглощению в далеком (вакуумном)
ультрафиолете (λ < 200 нм, Е
> 600 кДж/моль). Такие
переходы характерны для насыщенных
углеводородов (метан, этан). Для
аналитической практики они представляют
незначительный интерес, так как измерения
в этой области возможны только с
применением вакуумных спектрометров.
аибольшей
энергии требуют σ→σ*
переходы, связанные с возбуждением
внутренних электронов. Они соответствуют
поглощению в далеком (вакуумном)
ультрафиолете (λ < 200 нм, Е
> 600 кДж/моль). Такие
переходы характерны для насыщенных
углеводородов (метан, этан). Для
аналитической практики они представляют
незначительный интерес, так как измерения
в этой области возможны только с
применением вакуумных спектрометров.
Переходы п→σ* связаны с меньшими затратами энергии. Соответствующие им полосы расположены в обычном (невакуумном) ультрафиолете (λ = 200–300 нм).
Переходы п→π* и π→π* находятся в более длинноволновой области, имеют большую интенсивность по сравнению с другими переходами и поэтому очень важны для аналитической химии.
Наибольшей интенсивностью в спектрах поглощения обладают полосы переноса заряда. Они обычно находятся в ближней УФ-области и возникают в результате переноса электрона между МО, локализованными у двух разных атомов – донора и акцептора электронов. Чаще всего перенос электрона происходит с р-орбитали лиганда на d-орбиталь центрального иона и наоборот. К ним относятся многие π→π* переходы. Переносом заряда объясняется интенсивная окраска ионов МnО4–, СгО42–, окраска тиоцианатных, сульфосалицилатных, фенантролиновых комплексов железа (например, ион Fe2+ – акцептор электронов, 1,10-фенантролин – донор электронов). Комплексы с переносом заряда часто используют для фотометрического определения многих металлов.
В видимой и ближней УФ-областях можно наблюдать полосы поглощения, обусловленные внутриатомными d→d или f→f переходами электронов. Они характерны для ионов переходных металлов с неполностью заполненными d- или f-оболочками C точки зрения квантово-механических представлений такие переходы запрещены (∆L = 0). Снятие запрета c d→d переходов в комплексах чаще всего объясняют «частичным смешиванием» d- и p-орбиталей и переходом электрона с уже смешанных d-, р-орбиталей на d-орбитали, что не запрещено. Успешно интерпретирует спектры d- и f-элементов теория кристаллического поля, которая объясняет возможность подобных переходов в результате расщепления d-уровней в поле лигандов.
В спектре комплекса могут присутствовать полосы внутрилигандных, внутриатомных электронных переходов и полосы переноса заряда.
Электронные переходы являются наиболее сложными в связи с наложением колебательных, а при определенных условиях и вращательных переходов. Наложение большого числа колебательных переходов, структура которых не всегда разрешается, приводит к существенному уширению полос электронных спектров (рис. 2.5).
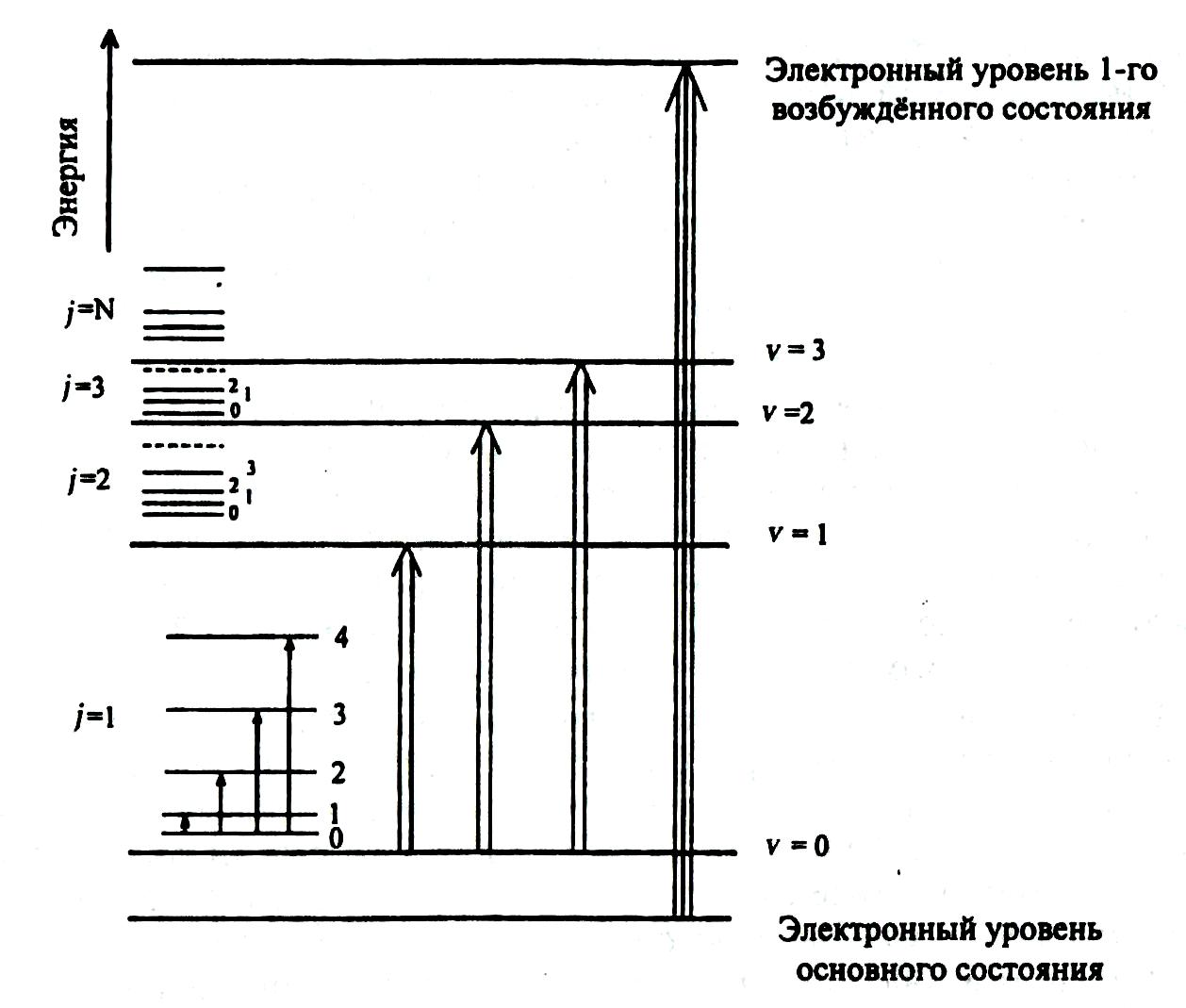
Рис.
2.5. Схема
относительного расположения вращательных
(j),
колебательных (V)
и электронных уровней в молекуле:
j
- вращательные
квантовые числа;
V
-
колебательные
квантовые числа.
