
- •Введение
- •Часть I строение и физиология микроорганизмов
- •Глава I. Строение и принципы систематики микроорганизмов
- •Бактерии
- •Неклеточные формы жизни
- •Водоросли и водные грибы
- •Простейшие
- •Глава II. Химический состав клетки
- •Вода и минеральные соли
- •Органические вещества клетки
- •Синтез белка
- •Мутагенез
- •Глава. III. Ферменты
- •Ферменты—биологические катализаторы
- •Строение и свойства ферментов
- •Принципы классификации ферментов
- •Окислительно-восстановительные ферменты (оксиредуктазы)
- •Регуляция синтеза ферментов
- •Глава IV. Получение энергии микроорганизмами Энергетический и конструктивный обмены
- •Получение энергии литотрофами
- •Получение энергии органотрофами
- •Взаимосвязь процессов обмена в организме
- •Глава V. Закономерности роста и развития микробных культур Рост, развитие, размножение
- •Понятие об абсолютной и относительной скорости роста
- •Особенности выращивания микроорганизмов в проточных культурах
- •Фазы развития микробной культуры
- •Влияние лимитирующих факторов на скорость роста
- •Скорость роста и физиологическая активность
- •Глава VI. Влияние внешних факторов на микроорганизмы Влияние температуры
- •Влияние влажности
- •Влияние лучистой энергии
- •Влияние осмотического давления
- •Активная реакция среды и окислительно-восстановительный потенциал
- •Часть II участие микроорганизмов в превращении веществ
- •Глава VII. Круговорот углерода
- •Распространение микроорганизмов в природе
- •Круговорот углерода и участие в нем микроорганизмов
- •Глава VIIII. Расщепление органических соединений в анаэробных условиях
- •Сбраживание углеводов
- •Маслянокислое брожение
- •Cбраживание жиров
- •Анаэробное расщепление белков
- •Глава IX. Расщепление органинеских соединений в аэробных условиях
- •Окисление углеводов
- •Окисление этанола. Получение уксусной кислоты
- •Окисление жиров
- •Окисление углеводородов
- •Расщепление азотсодержащих соединений
- •Глава X. Превращение соединений азота микроорганизмами Нитрификация
- •Денитрификация
- •Фиксация молекулярного азота
- •Глава XI. Превращение соединений серы микроорганизмами
- •Окисление соединений серы
- •Восстановление соединений серы
- •Глава XIII. Превращение соединений металлов микроорганизмами
- •Окисление соединений записного железа
- •Окисление соединений марганца
- •Выщелачивание металлов из руд
- •Часть III загрязнение и самоочищение водоемов
- •Глава XIIII. Экологические системы пресных водоемов Понятие экосистемы
- •Роль окружающей среды в формировании экосистемы
- •Особенности речных экосистем
- •Особенности озерных экосистем
- •Особенности экосистем водохранилищ
- •Глава XIV. Загрязнение водоемов
- •Характеристика основных видов загрязнения
- •Виды воздействия сточных вод на водоемы
- •Глава XV. Загрязнение водоемов и распространение водных инфекций
- •Понятие инфекции
- •Распространение инфекции
- •Водные инфекции
- •Понятие иммунитета
- •Противоэпидемические мероприятия
- •Глава XVI. Круговорот веществ и энергии в водоемах. Самоочищение водоемов
- •Поступление органических веществ в водоем с водосборной площади
- •Cинтез первичной продукции в водоеме
- •Превращение и деструкция органического вещества
- •Роль отдельных групп гидробионтов в самоочищении водоемов
- •Глава XVIII. Оценка степени загрязненности водоема Классификация водоемов по степени загрязненности
- •Санитарно-бактериологический анализ
- •Часть IV биологические процессы в системах Глава XVIII. Биологические помехи в водоснабжении
- •Помехи, вызываеалые аллохтонными организмами
- •Помехи, вызываемые автохтонными организмами
- •Влияние обрастаний на качество воды и материал труб
- •Меры борьбы с биологическими помехами
- •Глава XIX. Население очистных сооружений канализации
- •Глава XX. Экологические системы очистных сооружений канализации
- •Экосистемы искусственных аэрационных очистных сооружений
- •Экологические системы естественных аэрационных очистных сооружений
- •Экосистемы анаэробных очистных сооружений
- •Литература
- •Оглавление
Окисление соединений марганца
В природных условиях марганец находится преимущественно в виде окислов. Окислы марганца практически нерастворимы 1 воде, и поэтому могут мигрировать только в виде коллоидных растворов и взвесей. Двухвалентный марганец окисляется в четырехвалентный по уравнению:
![]()
При этой реакции выход энергии настолько незначителен, что он не может обеспечивать существование литотрофных микроорганизмом. И действительно, все микроорганизмы, участвующие в превращении соединений марганца, относятся в органотрофам. К окислению соединений марганца способны очень многие микроорганизмы, в том числе более половины почвенных бактерий и грибов. Превращение марганца не относится к жизненно важным функциям организма, а является побочной реакцией. Характерно, что окисление марганца гораздо интенсивнее идет в смешанных культурах.
Восстановление окислов марганца осуществляется факультативно-анаэробными микроорганизмами, причем процесс может идти даже в аэробных условиях. Особенно активно восстанавливают марганец энтеробактерии, бациллы и Thiobacillus thiooxidans.
Процесс восстановления окислов марганца не специфичен, т. е. не обнаружена группа микроорганизмов, специализирующаяся на получении кислорода путем восстановления окисленных соединений марганца.
В результате восстановительных процессов марганец переходит в растворимое состояние, а в результате окислительных—выделяется в виде отложений. Этот процесс был воспроизведен в лабораторных условиях Б. В. Перфильевым и Д. Р. Габе. Им удалось показать образование микрозон отложения марганца и железа микроорганизмами. В стерильных условиях микрозоны металлов не образовывались.
Из микрозон отложения марганца были выделены микроорганизмы своеобразной морфологии. Наиболее характерный представитель—Metallogenium. При изучении этого организма было показано, что он, как и Gallionella, выделяет стебельки из клетки, но в стебельках содержатся окислы не железа, а марганца. Клетки Metallogenium не имеют оболочки. Возможно, что выделение окислов марганца связано у бактерий с защитной функцией.
Metallogenium играет очень существенную роль в формировании отложений марганца. Вследствие деятельности факультативно-анаэробных микроорганизмов в болотах, илах, в почвах образуются растворимые соединения марганца. При попадании в окисную зону они окисляются бактериями и переходят в состояние нерастворимых окислов. В условиях достаточного обеспечения среды кислородом эти окислы устойчивы.
Восстановленные формы марганца могут сохраняться в том случае, если они защищены от аэробных условий поверхностными отложениями.
Выщелачивание металлов из руд
Изучение процесса выщелачивания металлов из руд представляет особый интерес для технологов очистки сточных вод, так как одна из основных задач этого производства—изучение возможности извлечения из сточных вод ценных примесей.
Основная роль в процессах выщелачивания принадлежит тионовым бактериям: Thiobacillus ferrooxidans и Th. thiooxidans. Как и все тионовые бактерии, эти микроорганизмы относятся к литоавтотрофам. Свое тело они строят из углекислоты, а необходимую им энергию получают при окислении неорганических соединений.
Th. ferrooxidans, как и все тионовые бактерии, способен окислять соединения серы, в том числе практически все известные сульфидные минералы, содержащие железо, медь, кобальт, никель, олово, молибден и т. д. При окислении сульфидной серы разрушается кристаллическая решетка и высвобождаются металлы.
Реакция протекает по схеме:
![]()
Образовавшееся закисное сернокислое железо в присутствии кислорода превращается в окисное:
![]()
Процесс идет в кислой среде. Оптимум рН для этой бактерии лежит в пределах 1,7—3,5. Аналогично из сульфидов в сульфаты окисляются и другие металлы.
Th. thiooxidans в качестве источника энергии использует элементарную серу, которую окисляет по уравнению:
![]()
К этой реакции способен и Th. ferrooxidans. Хотя непосредственного окисления сульфидов при этом не происходит, выделяющаяся сорная кислота химически растворяет сульфиды.
Таким образом, выщелачивание металлов из сульфидных руд может осуществляться микроорганизмами либо при непосредственном окислении сульфидов, либо в качестве побочной реакции при окислении серы.
Сульфит окисного железа способен реагировать с сульфидами различных металлов и при этом переходить в закисную форму:
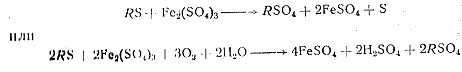
где R—какой-либо металл.
Образовавшееся окисное сернокислое железо вновь бактериальным путем окислятся до Fe(SO4)3 при гидролизе которого выделяется серная кислота:
![]()
Регенерация серной кислоты играет очень большую роль в процессах выщелачивания металлов, особенно в тех случаях, когда кислота расходуется на растворение сульфидов.
Во всех случаях активного выщелачивания цветных металлов из руд при анализах обнаруживается Th. ferrooxidans. На развитие этого организма и его активность влияют многие факторы. Как уже было сказано, оптимум рН для большинства культур лежит и пределах 1,7—3,5, но вид Thlobaclllus «у» окисляет сульфиды олова, свинца и висмута в нейтральной и щелочной среде. Для хорошего роста бактерий необходима обеспеченность среды минеральным питанием, особенно азотом (в виде солей аммония) и фосфором. Оптимальная температура для развития большинства штаммов лежит в пределах 30—35 °С, но известны и термофильные штаммы с оптимумом 55 °С. При обогащении урановых руд в шахтах отмечено, что процесс протекал нормально при температуре 18 °С и значительно замедлялся при 14 °С. Существенное влияние на процесс выщелачивания оказывают аэрация и степень измельчения руды.
Соли тяжелых металлов губительно влияют на бактерии, но Th. ferrooxidans отличается исключительной устойчивостью к тяжелым металлам и высокой степенью адаптации к ним. Отдельные штаммы этого вида удавалось адаптировать к концентрации меди 20 г/л, хлорного железа—16 г/л, цинка—10 г/л, мышьяка—2 г/л, уранила—1 г/л. Плохо адаптировались бактерии к молибдену. Предельно допустимая концентрация его составляет всего лишь 70—80 мг/л.
Процессы бактериального выщелачивания металлов весьма эффективны и очень экономичны. Они позволяют использовать так называемые «забалансовые» руды, т. е. руды с очень низким содержанием металлов. Для успешного применения этого метода необходимо дальнейшее выделение новых активных штаммов бактерий и изучение их геохимической способности.
