
Коагуляция
Пример 1. Для коагуляции 10 мл золя иодида серебра потребовалось 4,5 мл раствора нитрата бария молярной концентрации 0,05 моль/л Определить порог коагуляции электролита.
Решение. Порог коагуляции рассчитываем по уравнению:
 ,
,
где Спор – порог коагуляции, моль/м3; С(1/z* X) – молярная концентрация эквивалента электролита моль/м3; Vэл – объём электролита, м3; Vзоль – объём коагулирующего золя, м3;
в единицах СИ, поэтому предварительно сделаем пересчет молярной концентрации нитрата бария в молярную концентрацию эквивалента этого электролита, а миллилитры в кубические метры:
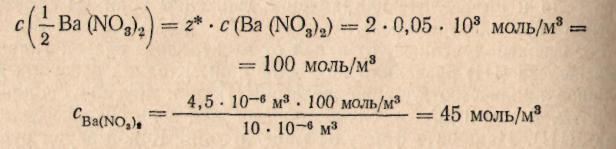
Пример 2. Для коагуляции 10 мл золя иодида серебра требуется 0,5 мл раствора нитрата кальция молярной концентрации эквивалента 0,2 моль/л или 0,2 мл раствора нитрата алюминия молярной концентрации эквивалента 0,03 моль/л или 1,5 мл раствора нитрата калия молярной концентрации 1 моль/л. Определите: а) пороги коагуляции, б) заряд частиц золя, в) отношение коагулирующем способности ионов.
Решение. Пороги коагуляции определяем по уравнению:
,
где Спор – порог коагуляции, моль/м3; С(1/z* X) – молярная концентрация эквивалента электролита моль/м3; Vэл – объём электролита, м3; Vзоль – объём коагулирующего золя, м3.
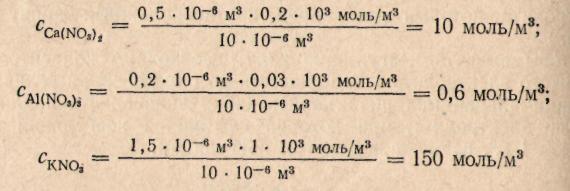
Разница в порогах коагуляции велика. Если же принять во внимание, что анион во всех электролитах один и тот же, то столь большая разница может быть связана только с коагулирующей способностью катионов. Они разные не только по своей природе, но и по валентности. Следовательно, гранулы несут отрицательный заряд.
Отношение Коагулирующей способности катионов будет:
![]()
Последнее отношение получается, если коагулирующую способность иона калия принять за единицу. Отсюда следует, что коагулирующая способность ионов кальция в 15 раз, а ионов алюминия в 250 раз выше, чем ионов калия.
2. Пороги коагуляции золя Fе(ОН)3 для электролитов КI и К2Сr2О7 соответственно равны 10,0 и 0,195 ммоль/л золя. Во сколько раз коагулирующая способность бихромата калия больше, чем у иодида калия.
Решение. Коагулирующие способности электролитов являются величинами, обратными их порогам коагуляции:
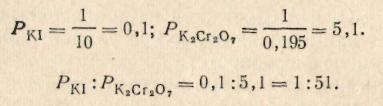
Для золя Fе(ОН)3 коагулирующая способность бихромата калия больше, чем иодида калия, в 51 раз.
