
Электрохимия
Пример 1. По данным о стандартных электродных потенциалах меди и цинка рассчитайте ЭДС элемента, составленного из полуэлементов:

Значения стандартных электродных потенциалов находим в справочнике, так как медный полуэлемент более электроположителен, то
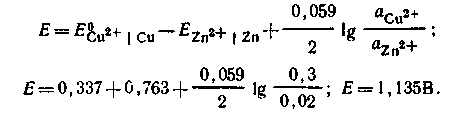
Пример 2. Рассчитайте ЭДС и напишите схему гальванического элемента, в котором обратимо протекает реакция по уравнению:
![]()
Решение. Определим уравнения электродных реакций. Для этого из уравнения реакции, приведенной в условии, вычитаем уравнение одной из предполагаемых электродных реакций

В справочнике находим соответствующие стандартные электродные потенциалы. Вычисляем электродные потенциалы по уравнению:

Подставляя значения Е1 и Е2 в уравнение:
Е = Е1 – Е2, получаем Е = 0,789 – 0,451 = 0,338 В. Схема элемента:
![]()
Пример 3. Рассчитайте константу равновесия реакции Cd2+ + Zn = Zn2+ + Cd, если Е0 (Сd2+/Cd) = -0,403 В; E0 (Zn2+/Zn) = -0,763 В.
Решение. Константу равновесия вычислим по уравнению:
![]() при
298 К
при
298 К
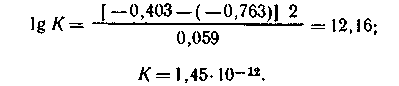
Пример 4. Вычислите полезную работу W реакции Ag + ½ Cl2 = AgCl, используя стандартные электродные потенциалы, если p (Cl2) = 1 атм, Т = 298 К.
Решение. Полезная работа реакции при p и Т = const будет W = -ΔG. Для электрохимической реакции в стандартных условиях ΔG0 = -nE°F. ЭДС элемента равна Е° = E°1 – E02, где E°1 и E02 - стандартные потенциалы электродов, составляющих элемент. Рассматриваемая реакция осуществляется в элементе по схеме:

Адсорбция
Пример 1. Определить суммарную поверхность частиц, если при дроблении 1 г серы получили частицы: 1) кубической формы с длиной ребра, равной 10-5 см; 2) частицы шарообразной формы с поперечником 2·10-6 см. Плотность серы 2,07 г/см3.
Решение. 1. Используем формулу:
![]()
1 г серы занимает объем
![]()
Учитывая объем 1 г серы, получим суммарную поверхность частиц
![]()
2. Для частиц шарообразной формы используем формулу:
![]()
Учитывая объем серы, находим общую поверхность всех частиц:
![]()
Пример 2. Определить число частиц, образующихся при раздробленности 0,2 см3 ртути на правильные кубики с длиной ребра 8·10-8 см. Плотность ртути равна 13,546 г/см3.
Решение. Находим массу 0,2 см3 ртути:
![]()
Определяем объем одной частицы:
![]()
Масса одной частицы будет равна:
![]()
Число частиц:
![]()
Пример 3. Определить поверхностный избыток (кмоль/м2) при 10 °С для раствора, содержащего 50 мг/л пеларгоновой кислоты С8Н17СООН. Поверхностное натяжение воды при данной температуре 74,22·10-3 н/м, а исследуемого раствора 57,0·10-3 н/м.
Решение. Определяем концентрацию кислоты в кмоль/м3. В 1 л содержится 0,05 г кислоты. В 1 м3 этого раствора будет 0,05 кг кислоты, т.е. 0,05/158 кмоль/м3, где 158 – молярная масса пеларгоновой кислоты с1 = 0.

![]()
Гак как Г > 0 и σ2 < σ1, то адсорбция положительна.
Пример 4. К 100 см3 раствора уксусной кислоты различной концентрации при 20 °С добавили по 3 г активированного угля. Количество кислоты до и после адсорбции определяли титрованием 50 см3 раствора 0,1 н. раствором NaOH в присутствии фенолфталеина. Определить соотношение х/m для каждого раствора кислоты, используя данные титрования

Решение. Определяем нормальность N, титр Т и содержание уксусной кислоты (г) в 100 см3 раствора (с) до и после адсорбции.
До адсорбции:
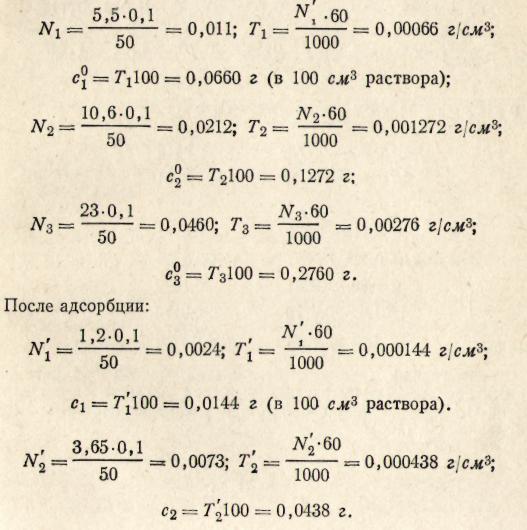

Определяем количество кислоты, адсорбировавшееся 1 г активированного угля,

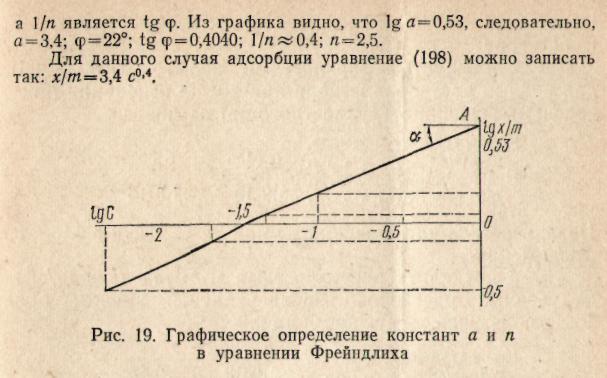
Пример 5. На основе опытных данных, полученных при изучении адсорбции углем бензойной кислоты из раствора ее в бензоле при 25 °С, определить графически константы а и 1/n в уравнении Фрейндлиха:
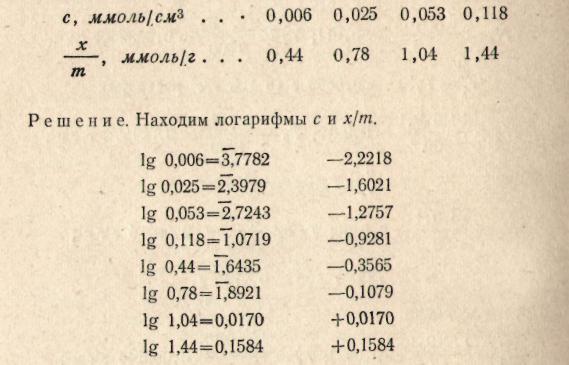
Строим график, откладывая на оси ординат lg х/m, а на оси абсцисс lg c. (Округляем значения логарифмов до сотых)
Отрезок ОА представляет собой lg а в уравнении изотермы адсорбции Фрейндлиха:
![]()
Пример 6. При адсорбции аргона коксовым углем при 194,7 К получены следующие результаты

Рассчитайте постоянные в уравнении Лэнгмюра.
Решение. Согласно уравнению Лэнгмюра а/а∞ является угловым коэффициентом прямой зависимости между Р/а и Р, а 1/bах – отрезком, отсекаемым этой прямой на оси ординат. Вычисляем величины Р/а:
![]()
По полученным данным строим график, отложив на оси абсцисс Р, а на оси ординат – P/a. Как видно из графика (рис. 40):


Пример 7. Объем газообразного азота Vm при 1,04·105 Па (750 мм рт. ст.) и 273 К, необходимый для покрытия образца силикагеля мономолекулярным слоем, 129 мл/г. Вычислите площадь поверхности 1 г силикагеля, если молекула азота занимает площадь 16,2·10-20 м2.
Решение. Площадь вычисляем по уравнению:
![]()
Пример 8. Превращение пероксида бензоила в диэтиловый эфир (реакция первого порядка) при 333 К прошло за 10 мин на 75,2 %. Вычислите константу скорости реакции.
Решение. Напишем уравнение первого порядка и подставим в него соответствующие значения:

Пример 9. Тростниковый сахар (биоза) в присутствии ионов Н+ гидролизуется водой, распадаясь на две монозы (глюкозу и фруктозу) по уравнению:
![]()
Раствор тростникового сахара вращает плоскость поляризации света вправо, а смесь глюкозы и фруктозы – влево. Угол вращения в обоих случаях пропорционален концентрации растворенных веществ. При 298 К в 0,5 н. растворе НCl при большом избытке воды изменение угла вращения α плоскости поляризации раствора тростникового сахара во времени t было следующее
![]()
Рассчитайте константу скорости реакции и количество сахара (%), которое инвертируется в течение 236 мин. Определите угол вращения к моменту времени t = 236 мин.
Решение. Обозначим угол вращения в начальный момент α0, после окончания инверсии α∞ и наблюдаемый в данный момент α1. Так как от начального до конечного момента угол вращения изменится на α0 – α1, то эта величина пропорциональна начальной концентрации сахара с0,A, концентрация же сахара в данный момент с0,A – х пропорциональна изменению угла вращения от данного момента α1 до конца инверсии α∞, т.е. пропорциональна αt – α∞. Реакция инверсии сахара в присутствии большого избытка воды идет по первому порядку. Рассчитываем константу скорости реакции по уравнению, заменив с0,A и с0,A – х пропорциональными величинами α0 – α∞ и αt – α∞:
![]()
![]()
Определяем количество сахара, которое инвертируется в течение 236 мин. Для этого, подставив в уравнение вместо k1 и t соответственно 0,005028 и 236 мин, получим
![]()
Откуда получаем количество гидролизованного сахара:
![]()
Определяем угол вращения, соответствующий t = 236 мин. Когда все начальное количество сахара проинвертирует, изменение угла вращения составит 25,16° - (-8,38°) = 33,54°. Так как при t = 236 мин остается 30,52 % сахара, не подвергшегося гидролизу, то изменение угла вращения, вызванное превращением этого количества, будет соответственно меньше. Обозначим его через z, тогда
![]()
Так как z = αt – (8,38°), то αt = z – 8,38° = 10,23° - 8,38° = +1,85°, т.е. реагирующая смесь спустя 236 мин после начала реакции будет иметь правое вращение, равное 1,85°.
Пример 10. Скорость реакции (C2H5)3N + CH3I = [(C2H5)3CH3N]I в нитробензоле определялась при 298 К, причем получены следующие данные:
![]()
где t – время; х – количество триэтиламина и метилиодида, прореагировавших за время t. Начальные концентрации амина и иодистого алкила равны 0,0198 моль/л. Рассматриваемая реакция – второго порядка. Определите константу скорости.
Решение. Для реакции второго порядка, в которой реагируют два вещества с одинаковыми концентрациями:
![]()
k = 0,0334; 0,0327; 0,0329; 0,0332; 0,0328; 0,0325.
Среднее значение k = 0,0329 л·моль-1·с-1.
Пример 11. Для химической реакции А = В константа скорости k = 0,5, исходная концентрация c0,A = 1 моль/л. Вычислите степень превращения вещества А за время t = 1 ч, если реакция идет по нулевому, первому, второму порядку. Как зависит степень превращения от порядка реакции?
Решение. Для реакции, протекающей по нулевому порядку, согласно уравнению
![]()
Для реакции, протекающей по первому порядку, согласно уравнению
![]()
Для реакции, протекающей по второму порядку, согласно уравнению
![]()
Чем выше порядок, тем меньше степень превращения, тем медленнее идет реакция.
