
Растворы
Пример 1. Вычислить число степеней свободы, которыми обладает система, состоящая из: а) раствора КNO3 и NaNO3 в присутствии кристаллов обеих солей и паров воды; б) раствора обеих солей в присутствии льда, кристаллов КNO3, NaNO3 и паров воды; в) раствора обеих солей в присутствии льда и паров воды.
Решение. Поскольку между КNO3, NaNO3 и водой не наблюдается химического взаимодействия, то число компонентов равно числу составных частей системы, т.е. К = 3. Используем уравнение правила фаз для каждого случая (а), (б), (в): а) в равновесии находятся четыре фазы: жидкая, пары воды и две твердые (КNO3 и NaNO3). Следовательно, с = 3 + 2 – 4 = 1. Это одновариантная система.
б) число фаз, находящихся в равновесии, равно 5 (ф = 5): пары воды, жидкость, лёд, кристаллы КNO3 и NaNO3: с = 3 + 2 – 5 = 0. Безвариантная система. Степени свободы отсутствуют. Равновесие существует при строго заданных температуре и концентрациях солей.
в) число фаз, находящихся в равновесии, равно трём (ф = 3): пары воды, лёд, жидкий раствор двух солей: с = 3 + 2 – 3 = 2. Это двухвариантная система. Можно произвольно (до некоторого предела) изменять температуру и концентрацию одной из солей.
Пример 2. При сплавлении солей КСl и NaNO3 возможна реакция
КСl + NaNO3 = КNO3 + NaСl
Определить число степеней свободы, если жидкий расплав находится в равновесии с кристаллами NaNO3.
Решение. Число независимых компонентов находим по разности: число составных частей системы минус число химических реакций, протекающих в данной системе при данных условиях: к = 4 – 1 = 3; ф = 2 (жидкий расплав и кристаллы NaNO3). Соли КСl, KNO3, NaCl и NaNO3 нелетучи. Поэтому можно считать систему конденсированной. Используем уравнение правила фаз: с = к+1 – ф = 3 + 1 – 2 = 2. Система двухвариантна.
Пример 3. Температура кипения ртути под нормальным атмосферным давлением 357 °С. Теплота парообразования 283,2 Дж/г. Определить изменение упругости пара ртути при изменении температуры на 1 ° вблизи температуры кипения ртути под нормальным атмосферным давлением
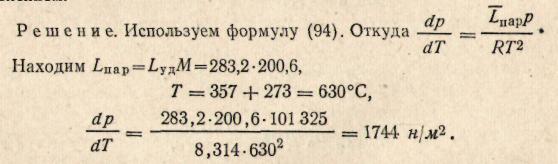
Пример 4. Давление паров воды при 97 0С равно 90919,9 н/м2, а при 103 0С 112651,8 н/м2. Определить давление паров воды при 110 0С.

Пример 5. Удельная теплота плавления нафталина при его нормальной температуре плавления 79,9 °С равна 149,25 Дж/г. Разность удельных объемов в жидком и твердом состояниях при температуре плавления (Δυ) 0,146 см3/г. Определить изменение температуры плавления нафталина при увеличении давления в 100 раз по сравнению с нормальным атмосферным давлением (101325 н/м2).

Так как давление дано в н/м2, то изменение удельного объема нужно выразить в м3/кг, а теплоту плавления – в Дж/кг. Поскольку Δυ – разность удельных объемов, то вместо мольной теплоты плавления можно взять удельную теплоту плавления (Дж/кг):
![]()
Изменение температуры плавления при увеличении давления в 100 раз по сравнению с нормальным атмосферным давлением (т.е. при 1,013·107 н/м2) равно 3,453·10-7 · 1,013·107 = 3,5 0.
Пример 6. Вычислить осмотическое давление 2%-ного раствора глюкозы при 0 °С. Плотность раствора принять равной единице.
Решение. Осмотическое давление вычисляем по формуле:
π = СМRT.
Концентрация раствора должна быть выражена в кмоль/м3, М (C6H12O6) = 180.
В 100 кг 2%-ного раствора содержится 2 кг глюкозы. Плотность данного раствора 1. Следовательно, в 1000 л или в 1 м3 содержится 20 кг глюкозы, что составляет 20/180 кмоль/м3.
![]()
Пример 7. Осмотическое давление 0,1 н. раствора сульфата цинка при 0 °С равно 1,59·105 н/м2. Определить кажущуюся степень диссоциации соли в данном растворе.
Решение. Концентрация раствора сульфата цинка равна 0,05 моль/л или 0,05 кмоль/м3. Для растворов электролитов применяем формулу:
π = iСМRT, из которой находим i
![]()
При диссоциации каждой молекулы соли образуется два иона
![]()
т.е. k = 2, так как i = 1 + α, то α = 1 – i = 1,401 – 1 = 0,40, или 40,1 %.
Пример 8. Определить концентрацию раствора глюкозы, если раствор этого вещества при 18 °С изотоничен с раствором, содержащим 0,5 моль/л хлорида кальция. Кажущаяся степень диссоциации СаСCl2 в растворе при указанной температуре составляет 65,4%.

Пример 9. Вычислить давление пара 10%-ного раствора мочевины СО(NН2)2 при 50 °С. Давление паров воды при 50 °С равно 12 320 н/м2.

В 100 г 10%-ного раствора мочевины содержится 10 г мочевины и 90 г воды; М (мочевины) = 60; М (воды) = 18. Определяем число молей мочевины (na) и воды (nb) в 100 г 10%-ного раствора
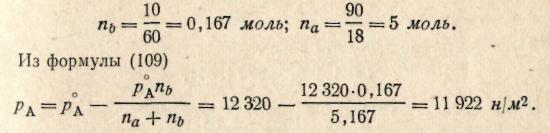
Пример 10. Давление пара чистого ацетона при 20 °С равно 23 940 н/м2. Давление пара раствора камфоры в ацетоне, содержащего 5 г камфоры на 200 г ацетона при той же температуре, равно 23710 н/м2. Определить молярную массу камфоры в растворе ацетона.
Решение. Так как раствор разбавленный, то можно, воспользовавшись упрощенной формулой, определить число молей камфоры
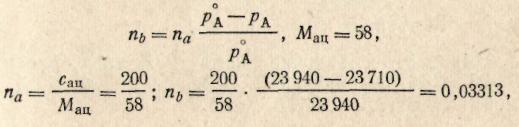
![]()
Пример 11. Давление пара раствора, содержащего 5 г едкого натра в 180 г воды при 100 °С, равно 99000 н/м2. Вычислить кажущуюся степень диссоциации едкого натра в данном растворе.
Решение. Используем формулу:
![]()
При 100 °С для воды рА° = 101325 н/м2. Число молей воды na = 180/18 = 10; число молей NaOH nb = 5/40.
![]()
При диссоциации каждой молекулы NaОН образуется два иона (А = 2). Для определения α используем уравнение α = 1 – i = 1,837 – 1 = 0,837, или 83,7 %.
Пример 12. Определить атмосферное давление, если 0,1 М раствор хлорида натрия кипит при 99,8 °С? Кажущаяся степень диссоциации 0,1 М раствора NaCl равна 84,4 %. Давление насыщенного пара чистой воды при 99,8 °С равно 100600 н/м2.
Решение. При температуре кипения давление пара растворителя над раствором равно атмосферному давлению. Следовательно, рассчитав рА, можно определить и атмосферное давление. Из формулы
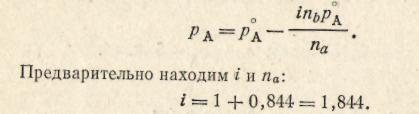
В 1 л 0,1 М раствора хлорида натрия содержится 5,85 г NaCl. Число молей воды (принимаем плотность раствора равной 1) равно:
na = (1000 – 5,85)/18 = 55,2 моль.
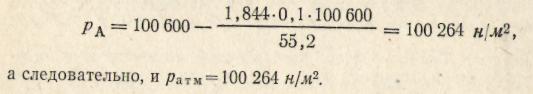
Пример 13. При какой примерно температуре должен замерзать 10 % водный раствор этилового спирта?
Решение. Используем формулу:

Раствор начнет замерзать примерно при -27 °С.
Пример 14. Раствор, содержащий 1,70 г хлорида цинка в 250 г воды, замерзает при -0,23 0С. Определить кажущуюся степень диссоциации хлорида цинка в этом растворе

Пример 15. Определить температуру кипения раствора едкого кали, содержащего в 100 г воды 14 г КОН. Кажущаяся степень диссоциации КОН в растворе равна 60 %.
Решение. Рассчитываем изотонический коэффициент i. Так как при диссоциации каждой молекулы КОН образуется два иона, то k = 2, тогда i = 1 + 0,6 = 1,6. М (КОН) = 56. Определяем моляльность раствора:

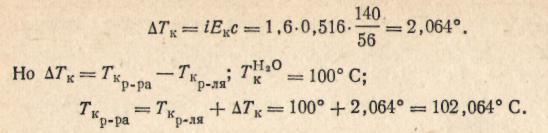
Пример 16. Температура кипения чистого бензола 80,100 °С, а раствора, содержащего 0,3020 г дифениламина в 30,14 г бензола, 80,255 °С. Скрытая теплота испарения бензола при температуре его кипения равна 396,0 Дж/г. Вычислить молекулярный вес дифениламина в бензоле

Табличное значение М дифениламина 169,23.
Пример 17. Водный раствор, содержащий нелетучее растворенное вещество (неэлектролит), замерзает при -3,5 °С. Определить температуру кипения раствора и давление пара раствора при 25 °С. Давление пара чистой воды при 25 °С 3167,2 н/м2.
Решение. Понижение температуры замерзания раствора равно:
0 – (-3,5) = 3,5 °;
Е3 и Ек находим по справочнику. По формуле определяем моляльную концентрацию раствора

Для вычисления давления пара раствора преобразуем формулу:

Пример 18. Плотность твердого фенола 1072 кг/м3, жидкого 1056 кг/м3, теплота его плавления 1,044·105 Дж/кг, температура замерзания 314,2 К. Вычислите dp/dT и температуру плавления фенола при 5,065·107 Па.
Решение. По уравнению Клапейрона-Клаузиуса рассчитываем dp/dT

Чтобы вычислить температуру плавления при заданном внешнем давлении, принимаем, что dT/dp в интервале давлений 1,0132·105-5,065·107 Па – величина постоянная, равная 4,214·10-8 К/Па. Тогда

Пример 19. Вычислите среднюю теплоту испарения СН4 в интервале температур от 88,2 до 113 К, используя следующие данные:

lg(p1/p2) = (ΔHф.п./2,3R)[(T2 – T1)/T2T1]
по уравнению:
lgp = A – B/T, из которого следует, что зависимость lgp от 1/T выражается прямой линией. Теплоту испарения можно определить по тангенсу угла наклона прямой, который равен: tgα = -ΔHисп./2,3R. Вычисляем для приведенных данных lgp и 1/T:
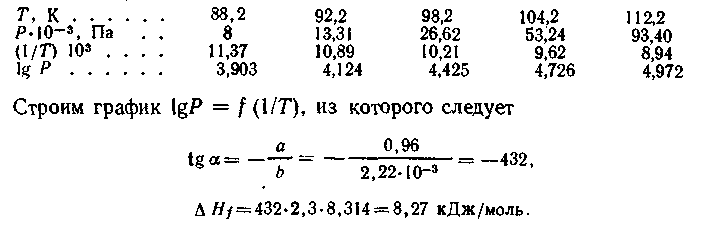
Этот результат более точен, чем предыдущий, так как вычислен на основании пяти опытов (истинное значение теплоты испарения метана при нормальной температуре кипения 8,19 кДж/моль).
Пример 20. Вычислите S0(H2Oпар), если S0(H2Oж) = 69,96 Дж/(моль·К).
Решение. Для расчета представим себе процесс превращения жидкой воды в пар под давлением 1,0132·105 Па, который состоит из двух стадий: 1) равновесное испарение под давлением, равным давлению насыщенного пара, ΔSисп.; 2) равновесное сжатие ΔSсж. насыщенного пара до давления 1 атм. Тогда
![]()
![]()
Для определения ΔНисп. по справочнику находим теплоты образования воды для разных агрегатных состояний при 298 К:
![]()
и давление насыщенного пара воды равно 3,167·103 Па. После подстановки чисел и вычислений получаем
![]()
и абсолютная энтропия пара составит:
![]()
Пример 21. При 268,2 К давление насыщенного пара твердого бензола 2279,8 Па, а над переохлажденным бензолом (жидким) 2639,7 Па. Вычислите изменение энергии Гиббса в процессе затвердевания 1 моль переохлажденного бензола при указанной температуре (пары бензола считать идеальным газом) и укажите, обратимый или необратимый процесс.
Решение. Поскольку изменение энергии Гиббса не зависит от пути процесса, принимаем, что процесс затвердевания состоит из трех стадий: 1) обратимое испарение жидкого бензола при давлении 2639,7 Па; 2) обратимое расширение паров до давления 2279,8 Па; 3) обратимая конденсация паров в твердую фазу. Тогда
![]()
как 1-я и 3-я стадии протекают при р и Т = const обратимо, то ΔG1 = ΔG3 = 0,
![]()
![]()
Результат указывает на необратимость данного процесса.
Пример 22. Давление насыщенного водяного пара при 428,2 К равно 54,3·104 Па, а удельный объем пара 0,3464 м3/кг. Рассчитайте фугитивность воды, находящейся при 428,2 К в равновесии со своим насыщенным паром.
Решение. Фугитивность жидкости равна фугитивности ее насыщенного пара, а так как давление относительно невелико, фугитивность насыщенного пара можно вычислить по уравнению

Пример 23. Давление водяного пара раствора, содержащего нелетучее растворенное вещество, на 2 % ниже давления пара чистой воды. Определите моляльность раствора
![]()
Приняв за 100 давление пара чистого растворителя р10 и подставив 98 вместо р1, получим
![]()
Для определения моляльности рассчитаем число молей растворенного вещества на 1000 г воды по уравнению:
x2 = n2/(n2 + n1),
где n1 – число молей воды (1000/18 = 55,55); n2 = m.
После подстановки значений в уравнение получаем:
0,02 = m/(55,55 + m), откуда m = 1,134.
![]()
Решение. Эбуллиоскопическую константу вычисляем по уравнению:
![]()
Пример 25. Определите температуру кипения водного раствора, содержащего 0,01 моль нелетучего вещества в 200 г воды. Кэ = 0,512 град/моль.
Решение. Вычисляем моляльность раствора:
![]()
По уравнению вычисляем температуру кипения раствора:
ΔТк. = Кэ.m

Пример 26. Понижение температуры замерзания водного раствора исследуемого вещества составляет 1,395 К, а бензольного – 1,280 К. Чем объясняется различие в ΔT, если моляльности растворов одинаковы? Какие величины, характеризующие состояние вещества в растворе, можно получить из этих данных? Для бензола Ккр = 5,16, град/моль; для воды Ккр = 1,86 град/моль.
Решение. Различия в температурах замерзания можно объяснить тем, что вещество в водном растворе дисссоциирует, а в бензольном – не диссоциирует. Можно вычислить коэффициент Вант-Гоффа i.
ΔТз. = Ккр.m или ΔТз. = iКкр.m.
Зная числовое значение i, можно сделать, согласно уравнению:
i = 1 + α(v – 1),
предположение о числе частиц, на которые распадается молекула растворенного вещества, и о степени диссоциации. Согласно сделанным предположениям
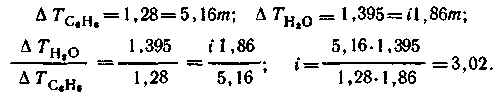
Если молекула, распадаясь, дает две частицы, то даже при α = 1 i = 2. Полученное значение i > 2 показывает, что v > 2.
Вычисляем степень диссоциации, предположив, что v = 3; тогда 2,52 = 1 + α (3 – 1), откуда α = 0,76. Если v = 4, α = 0,50 и т. д.
