
Законы термодинамики
Пример 1. Определить теплоту, которую отдадут 100 кг паров метилового спирта при охлаждении от 200 до 100° С при нормальном давлении.
Решение. Количество выделяемой теплоты можно рассчитать двумя способами:
используя значение средней (удельной) теплоемкости между 200 и 100 0С (с учетом массы паров спирта);
определяя среднюю теплоемкость паров метилового спирта от 0 до 200 °C и от 0 до 100 °С. Подсчитать отдельно относительные количества теплоты при 200 °С и при 100 °С (с учетом массы паров) и вычесть одно из другого. Полученное количество теплоты соответствует отданной 100 кг паров СН3ОН при их охлаждении.
Воспользуемся вариантом 2. Из таблицы находим для СН3ОН средние мольные теплоемкости при нормальном давлении для 200 и 100 °С(57,0 кДж/кмоль·град и 53,7 кДж/кмоль·град).
с = С/М

Пример 2. Определить теплоту, поглощаемую при нагревании 100 г двуокиси углерода от 15 до 1000 °С при постоянном объеме, если
![]()
Решение. Используем формулу (температуру можно взять в градусах Цельсия):

(для одного моля).
Определяем число молей СО2. Оно равно 100/44:

Пример 3. Рассчитать среднюю мольную теплоемкость водорода в интервале температур 400-500 °С, если

Решение. Используем формулу (значения температур оставляем в °С):
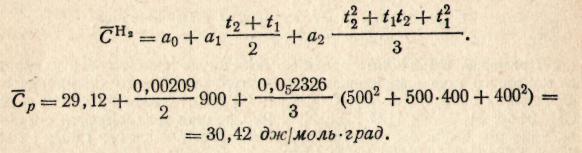
Пример 4. Средняя удельная теплоемкость двуокиси углерода в интервале от 0 до 1000° С выражается формулой
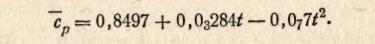
Рассчитать истинную мольную и удельную теплоемкости для двуокиси углерода при 200 °С.
Решение. В соответствии с формулой (50)
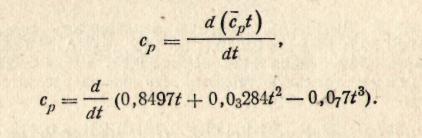
В результате дифференцирования и подстановки t = 200 0С получим
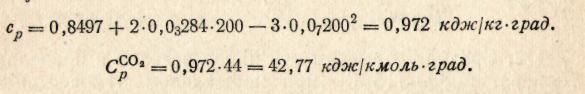
Пример 5. Средняя мольная теплоемкость кислорода при постоянном давлении в интервале температур от 0 до 1500 °С выражается формулой
![]()
Определить средние мольную, удельную и объемную теплоемкости при постоянном давлении в интервале температур от 0 до 1000 °С.
Решение. Рассчитаем среднюю мольную теплоемкость от 0 до 1000 °С:
![]()
Рассчитаем среднюю удельную теплоемкость по формуле:

Определим объемную теплоемкость по формуле:

Пример 6. Определить среднюю объемную теплоемкость влажного коксового газа в интервале температур от 0 до 20 °С, имеющего следующий состав (об. %): СО2 2,64; О2 0,79; СmНn 2,07; СО 5,08; СН4 24,66; Н2 58,00; Н2О 2,30; N2 4,46. Средние теплоемкости составляющих его газов соответственно равны (кДж/м3·град): 1,697; 1,303; 2,082; 1,274; 1,504; 1,295; 1,455; 1,270.
Решение. Среднюю объемную теплоемкость указанной смеси газов в интервале температур 0-20 °С можно рассчитать по формуле:
Соб = 1/100 (а0С1 + b0C2 + …)

Пример 7. Вычислить удельную теплоемкость сплава состава (вес. %): Вi 50,7; Рb 25,0; Си 10,1; 5п 14,2; если ср298 (кДж/кг·град): для висмута 0,122, свинца 0,129, кадмия 0,231, олова 0,221.
Решение. Удельную теплоемкость сплава рассчитаем по формуле:
C = ΣnCi
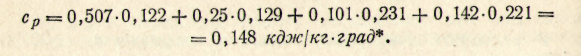
Пример 8. Определите работу изобарного обратимого расширения 3 моль идеального газа при его нагревании от 298 до 400 К.
Решение. Работу изобарного расширения определяем по уравнению:
W = nR(T2 – T1)

Пример 9. Определите работу испарения 3 моль метанола при нормальной температуре кипения.
Решение. Нормальная температура кипения – это температура кипения при внешнем давлении, равном 1,0133 · 105 Па. Нормальную температуру кипения находим в справочнике Тн.т.к. = 337,9 К. Работу определим по уравнению,
W = p(v2 – v1)
так как испарение происходит при постоянном давлении. Конечный объем приближенно можно определить по закону идеального газообразного состояния
![]()
В первом приближении объемом жидкости v1 можно пренебречь, так как объем жидкости при температурах, далеких от критической, значительно меньше объема пара. Тогда
![]()
Пример 10. Определите работу изотермического обратимого расширения 3 моль водяного пара от 0,5·105 до 0,2·105 Па при 330 К. Водяной пар при таких параметрах подчиняется закону идеального газообразного состояния.
Решение. Работу определим по уравнению:
W = nRTln(p1/p2)
![]()
Пример 11. Определите работу адиабатического обратимого расширения 3 моль аргона от 0,05 до 0,50 м3. Начальная температура газа 298 К.
Решение. Для определения работы адиабатического расширения воспользуемся уравнением:
W = nRT/(γ- 1) · [1 – (v1γ-1/ v2γ-1)].
Величину γ определим из Ср и Сv. Аргон – одноатомный газ. Следовательно, его изохорная теплоемкость на основании молекулярно-кинетической теории идеальных газов равна Сv =3/2 R = 1,5·9,3143 = 12,4715 Дж/(моль·К):
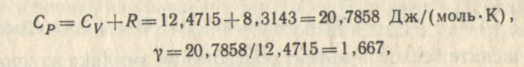
отсюда

