
- •1)Классификация орг. Соед.
- •2)Гибридизация ао.
- •3)Изомерия
- •4)Алканы. Строение св.
- •5)Алкены
- •6)Алкины
- •7)Алкадиены
- •Реакция электрофильного присоединения(ае) более характерна для алкадиенов.
- •Полимеризация диеновых углеводородов (см. Полимеризация).
- •8)Циклоалканы
- •1. Циклопропан и циклобутан способны присоединять бром :
- •2. Циклопропан, циклобутан и циклопентан могут присоединять водород, давая соответствующие нормальные алканы. Присоединение происходит при нагревании в присутствии никелевого катализатора :
- •9)Циклоалканы и терпены. Свойства применение
- •10)Арены.
- •11)Галогенпроизводные ув.
- •12)Механизмы реакций в орг.Химии
- •13)Классификация реагентов.
- •2. Структурообразующие коллоиды — материалы, придающие тиксо-тропные свойства раствору. Это неорганические коллоиды — глины (бентонит, палыгорскнт, асбест), а для растворов на нефтяной основе—
- •14)Эффекты заместителей.Индуктивный метожд
- •15)Нефть-природный источник ув
- •16)Основные теории происхождения нефти
- •18)Фракционный состав нефти
- •19)Бензин. Октановое число
- •20)Крекинг
- •21)Общее представление о механизмах термичского и кат крекинга.
- •22)Риформинг. Виды
- •23)Пиролиз. Назначение пиролиза
- •24)Полимеризация
- •26)Полимеры на основе алкенов
4)Алканы. Строение св.
Алка́ны (также насыщенные углеводороды, парафины, алифатические соединения) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С равны по форме и энергии, 4 электронных облака направлены в вершины тетраэдра под углами 109°28'. За счёт одинарных связей между атомами С возможно свободное вращение вокруг углеродной связи. Тип углеродной связи — σ-связи, связи малополярны и плохо поляризуемы. Длина углеродной связи — 0,154 нм.
Простейшим представителем класса является метан (CH4).
Химическое строение (порядок соединения атомов в молекулах) простейших алканов – метана, этана и пропана – показывают их структурные формулы, приведенные в разделе 2. Из этих формул видно, что в алканах имеются два типа химических связей:
С–С
и С–Н.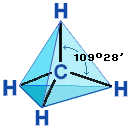
5)Алкены
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Углеводородные радикалы, образованные от алкенов имеют суффикс «-енил»
строение
В соответствии с теорией гибридизации двойная связь образуется за счет перекрывания вдоль линии связи С-С sp²-гибридных орбиталей атомов углерода (σ-связь) и бокового перекрывания углеродных p-орбиталей (π-связь).
Схема образования связей в молекуле этилена
В состоянии sp² гибридизации электронное состояние атома углерода можно представить следующим образом:
Все атомы этилена лежат в одной плоскости, а величина валентного угла связи C-H практически равна 120°. Центры углеродных атомов в этилене находятся на расстоянии 0,134 нм, то есть длина двойной связи несколько короче, чем С-С.
Согласно теории молекулярных орбиталей линейная комбинация двух атомных 2p-орбиталей углерода формирует две молекулярные π-орбитали этилена[1]:
6)Алкины
Перейти к: навигация, поиск
Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации, угол между орбиталями - 180 градусов, располагаются линейно.
Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения.
