
- •25 Стандартные окислительно-востановительные потенциалы. Определение направления реакции окисления- восстановления.
- •29 Энергетические уровни электрона в атоме . Главное квантовое число. Размер орбитали.
- •30.Орбитальное квантовое число l. Форма s – p- d- орбиталей. Энергетические подуровни в атомах . Порядок возрастания энергии подуровней.
- •31.Магнитное квантовое число и пространственная ориентация орбиталей. Спиновое квантовое число.
- •33. Принцип наименьшей энергии. Электронные формулы атомов. Основное, возбужденное и ионизированное состояние атома.
- •35.Периодический закон Менделеева и его трактовка на основе теории строения атома .S-/,p-, d-, b f-классификация химических элементов.
25 Стандартные окислительно-востановительные потенциалы. Определение направления реакции окисления- восстановления.
Связь между ∆G и φ выражается уравнением ∆G=n F φ,где n- количество вещества(моль),F-постоянная фарадея
Если в реакционной смеси присутствуют как исходные вещества, так и образуемые ими при протекании ОВР продукты реакции или, иначе говоря, два окислителя и два восстановителя, то направление реакции определяется тем, какой из окислителей в данных условиях в соответствии с уравнением Нернста окажется более сильным.
Любая запись уравнения ОВР предполагает определенный выбор окислителя в левой части уравнения. Если в стандартных условиях этот окислитель сильнее, реакция пойдет в прямом направлении, если нет – в обратном. Стандартный потенциал окислительно-восстановительной пары, в которой окисленной формой является выбранный нами окислитель, назовем потенциалом окислителя φоОк, а стандартный потенциал другой пары, в которой восстановленной формой является выбранным нами восстановитель – потенциалом восстановителя φоВс.
Величину Δφо = φоОк – φоВс назовем стандартной разностью окислительно-восстановительных потенциалов. После введения этих обозначений критерию направления реакции в стандартных условиях можно придать простой вид:
Если Δφо > 0, реакция в стандартных условиях протекает в прямом направлении; если Δφо < 0, то в обратном.
Количественной мерой окислительной способности окислителя (и одновременно восстановительной способностиего восстановленной формы) является электрический потенциал электрода φ (электродный потенциал), на котором одновременно и с равными скоростями протекают полуреакция его восстановления и обратная ей полуреакция окисления соответствующей восстановленной формы. Этот окислительно-восстановительный потенциал измеряется по отношению к стандартному водородному электроду и характеризует пару «окисленная форма – восстановленная форма» (поэтому выражения «потенциал окислителя» и «потенциал восстановителя», строго говоря, неверны). Чем выше потенциал пары, тем сильнее выражена окислительная способность окислителя и, соответственно, слабее – восстановительная способность восстановителя. И напротив: чем ниже потенциал (вплоть до отрицательных значений), тем сильнее выражены восстановительные свойства восстановленной формы и слабее - окислительные свойства сопряженного с ней окислителя. 26 Квантовый характер поглощения и излучения энергии атомами.Корпускулярноволновой дуализм микроцастиц.Характер движения электронав атоме.Волновая функция.Орбиталь.
Энергия распространяется и передается поглощается и испускается дискретно,отдельными порциями- квантами.
В 1900 г. немецкий физик М. Планк, изучавший тепловое излучение твердых тел, пришел к выводу, что электромагнитное излучение испускается в виде отдельных порций - квантов - энергии. Значение одного кванта энергии равно
ΔE = hν,
где ΔE - энергия кванта, Дж; ν - частота, с-1; h - постоянная Планка (одна из фундаментальных постоянных природы), равная 6,626·10−34 Дж·с. Кванты энергии впоследствии назвали фотонами.
Корпускулярно-волновой дуализм - способность микрочастицы, обладающей массой, размерами и зарядом, одновременно проявлять и свойства, характерные для волн, например, способность к дифракции. В зависимости от того, какие свойства частиц изучаются, они проявляют либо одни, либо другие свойства. Автор Эйнштейн который предложил рассматривать кванты электромагнитного излучения - фотоны - как движущиеся со скоростью света частицы, имеющие нулевую массу покоя. Их энергия равна
E = mc2 = hν = hc / λ,
где m - масса фотона, с - скорость света в вакууме, h - постоянная Планка, ν - частота излучения, λ - длина волны.
В 1924 г. французский физик Л. де Бройль предположил, что корпускулярно-волновыми свойствами обладает не только фотон, но и любая другая частица, движущаяся со скоростью v. Он получил уравнение, связывающее скорость движения частицы с длиной волны производимого ей электромагнитного излучения (уравнение де Бройля):
λ = h / mv,
где m - масса частицы, v - ее скорость, h - постоянная Планка; величина λ получила название длины волны де-Бройля.
Волновая функция комплекснозначная функция, используемая в квантовой механике для описаниячистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному):
![]()
где ![]() —
координатный базисный вектор, а
—
координатный базисный вектор, а ![]() —
волновая функция в координатном
представлении.
—
волновая функция в координатном
представлении.
Физический смысл волновой функции заключается в том, что согласно копенгагенской интерпретации квантовой механики плотность вероятности нахождения частицы в данной точке конфигурационного пространства в данный момент времени считается равнойквадрату абсолютного значения волновой функции этого состояния в координатном представлении.
Область пространства вокруг ядра, в которой наиболее вероятно пребывание электрона называют орбиталью, форму и размеры граничной поверзности считают формой и размером орбитали.Орбиталь можно описать с помощью набора квантовых чисел : n – главное квантовое число L- орбитальное квантовое число ml-магнитное квант. Ч. .
27Электронные формулы атомов.
Число электронов в атоме хим. Элемента определяется зарядом ядра, Ze где Z- номер элемента ( число протонов) ,e - заряд протона равный заряду электрона.Принцип Паули : в атоме не может быть более 2 электронов имеющих одинаковый набор всех четырех цифр. В - состоянии (одна орбиталь) м. б . 2 электрона, p-( 3 орбитали)-6, d-( 5 ) м. б. 10 , f- (7 ) 14 электронов.
Правило Гунда : при наличии нескольких пустых или наполовину заполненных ячеек данного подуровня электроны занимают максимально возможное число пустых ячеек.
28 Электронно- структурные диаграммы атомов.
Заполняя диаграмму, следует придерживаться следующих несложных правил:
сначала электроны заполняют самые низкие из свободных уровней энергии;
если конкретный уровень имеет более одного подуровня (для n=3;4…), то каждый из подуровней будет заполняться только одним электроном до тех пор, пока все подуровни этого уровня не будут иметь по 1 электрону. Только после этого эти подуровни будут заполняться вторыми электронами. (Правило Хунда).
Давайте
построим диаграмму для хлора
(Cl):
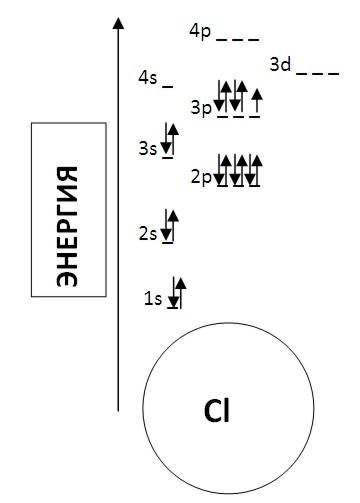 Порядковый
номер хлора в таблице - 17. Это значит,
что атом хлора содержит 17 протонов и 17
электронов. Т.е., нам на диаграмме надо
(согласно правилам) расположить 17
электронов.
Схематически
электрон отображается в виде стрелочки.
Если на орбитали находятся два электрона,
то они отображаются в виде двух
разнонаправленных стрелок (электроны
с разными спинами).
Сначала
заполняем самый низкий энергетический
уровень: 1s-орбиталь. На ней размещается
2 электрона.
Следующие
2 электрона занимают 2s-орбиталь.
Следующий
энергетический уровень: 2p-орбиталь - 6
электронов.
Следующие
2 электрона - 3s-орбиталь.
Оставшиеся
5 электронов располагаются на 3p-орбитали,
образуя две спиновые пары (у последнего
электрона пары нет).
Порядковый
номер хлора в таблице - 17. Это значит,
что атом хлора содержит 17 протонов и 17
электронов. Т.е., нам на диаграмме надо
(согласно правилам) расположить 17
электронов.
Схематически
электрон отображается в виде стрелочки.
Если на орбитали находятся два электрона,
то они отображаются в виде двух
разнонаправленных стрелок (электроны
с разными спинами).
Сначала
заполняем самый низкий энергетический
уровень: 1s-орбиталь. На ней размещается
2 электрона.
Следующие
2 электрона занимают 2s-орбиталь.
Следующий
энергетический уровень: 2p-орбиталь - 6
электронов.
Следующие
2 электрона - 3s-орбиталь.
Оставшиеся
5 электронов располагаются на 3p-орбитали,
образуя две спиновые пары (у последнего
электрона пары нет).

Сумма чисел, являющихся верхними индексами, равна порядковому номеру атома, т.е., количеству электронов в атоме.
Электроны, расположенные на внешнем незавершенном энергетическом уровне, называютсявалентными электронами.
