
- •2 Периодического закона
- •3. Строение атома
- •3.1 Квантово-механическое описание электрона в атоме
- •3.2 Квантовые числа
- •3.3 Атомные орбитали
- •4.Вопрос 1 Формирование электронной оболочки атома
- •4.2 Основные закономерности заполнения электронами уровней, подуровней и орбиталей в электронной оболочке атома
- •5 Общие представления о химической связи
- •5.2. Квантово-механическая теория химической связи
- •Типы химических связей и их свойства.
- •Параметры химической связи
- •7 Вопрос: Понятие химическое вещество и химическая реакция. Основные типы химических реакций.
- •8 Вопрос: Классификация химических реакций.
- •I. В зависимости от механизма реакции могут быть отнесены к простым и сложным.
- •II. По признаку изменения числа исходных и конечных веществ реакции можно выделить такие типы:
- •10 Вопрос
- •1 Понятие химического равновесия
- •2. Скорость химической реакции.
- •3. Константа равновесия
- •12 Вопрос: Смещение химического равновесия. Принцип Ле Шателье. Основныепричины смещения химического равновесия.
- •1 Изменение концентрации какого-либо из исходных веществ, участвующих в реакции (температура и давление постоянны):
- •14 Вопрос
- •Факторы, влияющие на скорость химической реакции
- •2.1 Зависимость скорости реакции от природы реагирующих веществ
- •2.2 Зависимостьскорости реакции от концентрации реагирующих веществ
- •2.3 Зависимостьскорости реакции от температуры
- •2.4 Зависимость скорости реакции от присутствия катализаторов.
- •15 Вопрос: Основные положения теории электролитической диссоциации.Истинные и потенциальные электролиты
- •2) Гидратация этих ионов.
- •16 Вопрос: Степень диссоциации. Константа диссоциации. Ионные реакции
- •17 Вопрос
- •18 Вопрос: Гидролиз солей. Степень гидролиза. Константа гидролиза
- •Гидролиз солей, соответствующих сильному основанию и слабой кислоте
- •Гидролиз солей, соответствующих слабому основанию и сильной кислот
- •19 Вопрос: Окислительно-востановительные реакции. Понятие окисления, восстановления, окислитель, восстановитель.
- •20 Вопрос: Типы овр. Типичные окислители и восстановители.
- •21Вопрос: Составление уравнений овр(м-д электронного баланса,м-д полуреакций)
- •22 Вопрос
- •Предмет органической химии
- •1.Многочисленность органических соединений по сравнению с неорганическими соединениями.
- •Первые теоретические воззрения
- •Теория строения а.М.Бутлерова
- •23 Вопрос
- •1. Тривиальная номенклатура
- •2 4 Вопрос
- •Общая характеристика: строение, классификация, номенклатура
- •25 Вопрос
1 Изменение концентрации какого-либо из исходных веществ, участвующих в реакции (температура и давление постоянны):
Увеличение концентрации одного из реагирующих веществ путем ввода в систему дополнительного количества этого вещества смещает равновесие в сторону прямой реакции (т. е. расходования части дополнительно введенного вещества).
Повышение концентрации одного из продуктов реакции смещает равновесие в сторону обратной реакции (по той же причине).
Уменьшение концентрации одного из исходных веществ ведет к смещению равновесия в сторону обратной реакции.
Уменьшение концентрации одного из продуктов - к смещению равновесия в сторону прямой реакции.
2. Нарушение равновесия вследствие изменения давления (путем уменьшения или увеличения объема, температура постоянна)

Отсюда вывод: при увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газа, т.е. в сторону понижения давления; при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул, т.е. в сторону увеличения давления.
3 Нарушение равновесия вследствие изменения температуры
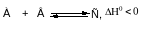
Повышение температуры вызывает смещение равновесия в сторону реакции, идущей с поглощением теплоты, а понижение температуры смещает равновесие в сторону реакции, идущей с выделением теплоты.
13 впрос
Понятие скорости химической реакции
Учение о скоростях и механизмах химических реакций называется химической кинетикой.
Механизм химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакций. При этом общее число атомов каждого элемента до и после реакции остается постоянным.
Реакции могут быть гомогенными и гетерогенными.Гомогенные реакции протекают в однородной среде (например, в газовой фазе или жидком растворе).Гетерогенные реакции протекают в неоднородной среде – между веществами, которые находятся в разных фазах (например, в твердой и жидкой или газовой и жидкой и т.д.).Гомогенные реакции происходят равномерно во всем объеме, заполненном реагентами. Гетерогенные – происходят на границе раздела фаз. Примером гетерогенной реакции может служить реакции между веществом в газовой фазе и поверхностью жидкого или твердого тела.
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (в случае гетерогенных реакций)
Скорость химической реакции обычно характеризует изменение концентрации одного из реагирующих веществ в единицу времени.
При этом безразлично, о каком из участвующих в реакциивеществе идет речь: все они связаны между собой уравнением реакции.
Обычно концентрацию выражают в [моль/л], а время — в секундах (с), поэтому размерность скорости реакции равна [моль/л • с].
Рассмотрим реакцию взаимодействия водорода с парами хлора:
Н2 + Cl2 2HCl
Обозначим концентрацию паров хлора в начале некоторого отрезка времени t1черезС1, а при t2 –С2. Так, хлор в процессе реакции расходуется, следовательно, С1>С2. Скорость реакции Vможет быть найдена из равенства
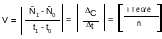
По мере расходования исходных веществ,скорость реакции уменьшается (рис. 1).

Рисунок 1- Изменение концентрации реагирующего вещества во времени
В ходе химических процессов концентрации веществ меняются непрерывно. Поэтому важно знать величину скорости реакции в данный момент времени, т.е. мгновенную скорость, которая выражается производной от концентрации во времени:
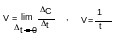
Мгновенная (истинная) скорость– это скорость реакции в конкретный момент времени.
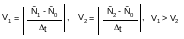
где: t – это время от начала химической реакции до момента появления видимых изменений (изменение окраски раствора, появление газа, осадка).
