
- •2 Периодического закона
- •3. Строение атома
- •3.1 Квантово-механическое описание электрона в атоме
- •3.2 Квантовые числа
- •3.3 Атомные орбитали
- •4.Вопрос 1 Формирование электронной оболочки атома
- •4.2 Основные закономерности заполнения электронами уровней, подуровней и орбиталей в электронной оболочке атома
- •5 Общие представления о химической связи
- •5.2. Квантово-механическая теория химической связи
- •Типы химических связей и их свойства.
- •Параметры химической связи
- •7 Вопрос: Понятие химическое вещество и химическая реакция. Основные типы химических реакций.
- •8 Вопрос: Классификация химических реакций.
- •I. В зависимости от механизма реакции могут быть отнесены к простым и сложным.
- •II. По признаку изменения числа исходных и конечных веществ реакции можно выделить такие типы:
- •10 Вопрос
- •1 Понятие химического равновесия
- •2. Скорость химической реакции.
- •3. Константа равновесия
- •12 Вопрос: Смещение химического равновесия. Принцип Ле Шателье. Основныепричины смещения химического равновесия.
- •1 Изменение концентрации какого-либо из исходных веществ, участвующих в реакции (температура и давление постоянны):
- •14 Вопрос
- •Факторы, влияющие на скорость химической реакции
- •2.1 Зависимость скорости реакции от природы реагирующих веществ
- •2.2 Зависимостьскорости реакции от концентрации реагирующих веществ
- •2.3 Зависимостьскорости реакции от температуры
- •2.4 Зависимость скорости реакции от присутствия катализаторов.
- •15 Вопрос: Основные положения теории электролитической диссоциации.Истинные и потенциальные электролиты
- •2) Гидратация этих ионов.
- •16 Вопрос: Степень диссоциации. Константа диссоциации. Ионные реакции
- •17 Вопрос
- •18 Вопрос: Гидролиз солей. Степень гидролиза. Константа гидролиза
- •Гидролиз солей, соответствующих сильному основанию и слабой кислоте
- •Гидролиз солей, соответствующих слабому основанию и сильной кислот
- •19 Вопрос: Окислительно-востановительные реакции. Понятие окисления, восстановления, окислитель, восстановитель.
- •20 Вопрос: Типы овр. Типичные окислители и восстановители.
- •21Вопрос: Составление уравнений овр(м-д электронного баланса,м-д полуреакций)
- •22 Вопрос
- •Предмет органической химии
- •1.Многочисленность органических соединений по сравнению с неорганическими соединениями.
- •Первые теоретические воззрения
- •Теория строения а.М.Бутлерова
- •23 Вопрос
- •1. Тривиальная номенклатура
- •2 4 Вопрос
- •Общая характеристика: строение, классификация, номенклатура
- •25 Вопрос
25 Вопрос
Способы получения алканов
Гидрирование ненасыщенных углеводородов.
СН2=СН2 + Н2 СН3- СН3;
СН≡С–СН3 + 2Н2 СН3–СН2–СН3
Гидрирование газообразным водородом протекает в присутствии катализаторов и чаще всего под давлением. Наиболее сильными катализаторами являются металлы платиновой группы в мелко раздробленном состоянии. Часто используются катализаторы типа «никеля Ренея».
Из галоидных алкилов.
Реакция Вюрца (1870г.). Способ заключается в действии натрия на галоидные алкилы. При этом два углеводородных остатка соединяются, образуя молекулу углеводорода:
2 СН3- СН2I + 2Na СН3–СН2–СН2–СН3 + 2NaI
Можно брать и два разных галоидных алкила. В этом случае образуется смесь трех разных алканов.
СН3I + С2Н5I +2Na СН3–СН3 + СН3–СН2–СН2–СН3 + СН3–СН2–СН3+ 2NaI
Реакция протекает в две стадии:
а) образование натрийалкилов:
СН3- СН2I + 2Na NaI + СН3–СН2–Na
б) действие на них галоидалкилов с образованием алкана:
СН3– СН2–Na+ СН3- СН2I NaI + СН3–СН2–СН2–СН3
Вместо натрия используются и другие металлы (например, цинк). Реакция Вюрца имеет большое значение не только для синтеза углеводородов, но и для доказательства их строения.
Из карбоновых кислот.
Нагревание солей карбоновых кислот с натронной известью или едким натром приводит к образованию алканов:

Промышленный синтез из оксида углерода (2) (Синтез Фишера, Тропша).
При пропускании смеси СО и Н2 при t = 200 С и атмосферном давлении над катализатором Fe и Со образуется смесь алканов – «синтин», состоящая из н-парафинов с примесью разветвленных:
nCO + (2n+1)H2 → СnH2n+2 + nH2n+2
Крекинг и пиролиз алканов нефти:
СnH2n+2 СmH2m+2 + Сn-mH2(n-m)
Физические свойства алканов
Согласно теории химического строения, физические свойства веществ зависят от их состава и строения.
Наиболее закономерно в гомологическом ряду предельных углеводородов изменяются температуры кипения. Первые четыре члена ряда: метан, этан, пропан и бутан, при комнатных условиях – газы. Алканы С5–С15 – жидкие, а С16 и далее – твердые. Начиная с н-С5, при переходе от одного гомолога н-алкана к другому температура кипения растет каждый раз на 25-30С, причем эта «гомологическая разность» постепенно уменьшается, снижаясь у 18-го члена ряда до 14С.
С5 |
С6 |
С7 |
С8 |
……. |
С16 |
С17 |
С18 |
36,2 |
69,0 |
98,0 |
125,8 |
287,5 |
303,0 |
317,0С |
Превращению жидкого вещества в газообразное противо-действуют слабые силы взаимного притяжения атомов разных молекул. Это притяжение тем больше, чем больше атомов в молекуле и чем сильнее могут сближаться их атомы. Первый фактор проявляется в плавном повышении температур кипения гомологов нормального строения. Закон перехода количественных изменений в качественные в данном случае имеет очень удачное приложение. Постепенное увеличение молекулярной массы на 14 (молекулярная масса группы –СН2–) от одного гомолога к другому приводит к резкому скачку в свойствах – изменению агрегатного состояния: С4 – газ, а уже С5 – жидкость.
Второй фактор проявляется в различии tкип изомерных углеводородов, имеющих одинаковую молекулярную массу. Нормальные углеводороды, молекулы которых лучше всего упаковываются в жидкой фазе, обладают наивысшими температурами кипения и наибольшей плотностью. Наиболее разветвленные – наинизшими температурами кипения и плотностями (табл.1).
Таблица 1– Температуры кипения, плавления и
плотности изомеров пентана
Соединение |
tкип.,С |
d420, г/см3 |
tплав,С |
н-Пентан |
36,2 |
0,6260 |
-131,6 |
изо-Пентан |
28,0 |
0,6197 |
-160,5 |
нео-Пентан |
9,5 |
0,5910 |
-20,0 |
Твердые алканы кристалличны. Температура плавления отражает прочность межмолекулярных связей в кристалле. Она также определяется молекулярной массой соединения и в большой мере зависит от геометрических факторов упаковки молекул в кристаллической решётке. Чем симметричнее построена молекула, тем легче и прочнее её упаковка в кристалле и тем выше температура плавления. Так, степень симметрии молекул изомерных пентанов возрастает в следующей последовательности: изопентан, н-пентан, неопентан
СН3
׀
СН3–СН–СН2–СН3, СН3–СН2–СН2–СН2–СН3, СН3–С–СН3,
׀ ׀
СН3 СН3
что вполне соответствует указанной закономерности (смотри выше).
Некоторые соединения, конформации которых лишены каких-либо элементов симметрии, вообще не могут кристаллизоваться, или кристаллизуются очень трудно. Например, 3-метилпентан; 3-метилгептан; 2,3-диметилпентан. Эти соединения при замораживании стеклуются.
Химические свойства алканов
Углеводороды ряда метана при обыкновенной температуре химически весьма инертны. Поэтому они и получили название парафинов (обладают малым сродством). С большинством химических реагентов алканы или вовсе не реагируют, или реагируют весьма медленно. Они не присоединяют водород (отсюда – предельные), не реагируют без инициирования с Cl2 и Br2, не окисляются на холоду такими сильными окислителями, как перманганат и хромовая кислота. При высоких температурах протекают лишь некоторые реакции замены атомов водорода на различные атомы и группы. При этом получаются производные углеводородов.
В алканах связи С–Н и С–С малополярны и прочны. Поэтому для образования карбкатионов и карбанионов (гетеролитический разрыв связи) нужно много энергии. В то же время эти связи сравнительно легко подвергаются гомолитическому разрыву с образованием радикалов. Поэтому для алканов в большей мере свойственны реакции радикального замещения.
Галоидирование.
На свету алканы могут последовательно замещать атомы водорода на атомы галоида, например:
CH4 + Cl2 CH3Cl + HCl хлористый метил
CH3Cl + Cl2 CH2Cl2 + HCl хлористый метилен
CH2Cl2 + Cl2 ® CHCl3 + HCl хлороформ
CHCl3 + + Cl2 ® CCl4 + HCl четыреххлористый углерод.
В.В.Марковников установил, что после замещения одного атома водорода хлором, замещение оставшихся атомов водорода облегчается.
Реакции галоидирования алканов протекают по радикальному цепному механизму. Этот механизм был открыт и доказан советским ученым Семёновым (Нобелевская премия).
Для начала реакции необходимо образование свободного радикала.
Энергия диссоциации связей при 25С:
С–С – 345,6 кДжмоль-1;
С–Н – 413,0 кДжмоль-1;
Cl–Cl – 242,7 кДжмоль-1.
Легче других разрывается связь Cl–Cl. При подведении энергии извне (тепло, электрическое поле, солнечный свет) образуются два радикала Cl.

Далее:
-
CH4 + Cl CH3 + HCl
CH3× + Cl2 ® CH3Cl + Cl
CH3Cl + Cl× CH2Cl× + Cl
CH2Cl + Cl2 ® CH2Cl2 + Cl
– это реакция роста цепи
и т.д., до CCl4.
При этом получаются довольно длинные цепи – порядка 1000 звеньев (актов взаимодействия) на один атом хлора.
Обрыв цепи происходит вследствие рекомбинации атомов хлора:
Cl + Cl Cl2
или вследствие реакции атома хлора со свободным радикалом (что вероятнее):
Cl + CH3® CH3Cl
Хлорирование метана, особенно с целью получения CCl4, проводится в промышленном масштабе. Галогеналканы служат исходными веществами для многих органических синтезов.
Нитрование.
При температуре 500С метан под воздействием азотной кислоты и двуокиси азота нитруется:
CH4 + HО–NO2 CH3NO2 + H2O
Этан в этих условиях реагирует по двум направлениям:
СН3–СН3 + HNO3 СН3–СН2NO2 + H2O
СН3–СН3 + 2HNO3 2CH3NO2
Реакция протекает по радикальному, возможно – цепному механизму. NO2 играет роль инициатора. Нитрометан используется в синтезе взрывчатых веществ и как растворитель.
При нитровании по Коновалову в мягких условиях разбавленной HNO3 и нагревании до 140 С водородный атом вторичного и тем более третичного углерода замещается на нитрогруппу гораздо легче первичного:
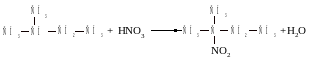
В газовой среде и высоких температурах такой избирательности нет.
Сульфирование.
Серная кислота (олеум) при нагревании медленно сульфирует алканы с третичным атомом углерода:

Сульфохлорирование.
Под действием ультрафиолетового освещения алканы вступают в реакцию замещения со смесью SO2 + Cl2:
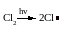
С2H6 + Cl С2H5 + HCl


Сульфохлорированию чаще всего подвергают смесь парафинов (синтин). Смесь сульфохлоридов в этом случае используют для получения моющих средств.
Окисление.
Хромовая смесь, перманганат калия и другие окислители при обычных условиях на алканы не действуют. У изоалканов сравнительно легко окисляется третичная группа СН. Промышленный интерес представляет каталитическое окисление смеси высших предельных углеводородов С8 – С18:

Смесь спиртов применяется для получения пластификаторов пластических масс, карбоновые кислоты – для приготовления моющих средств.
Дегидрирование.
При t = 300-400С алканы, пропущенные над катализатором окисидом хрома и алюминия, теряют два атома водорода и превращаются в алкены:

Реакция имеет важное значение в промышленности при получении дивинила и изопрена – мономеров синтеза каучуков.
Изомеризация.
Под действием кислых катализаторов (например, AlCl3) алканы способны к перестройке углеродного скелета:

