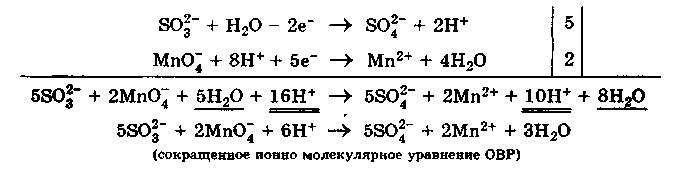- •2 Периодического закона
- •3. Строение атома
- •3.1 Квантово-механическое описание электрона в атоме
- •3.2 Квантовые числа
- •3.3 Атомные орбитали
- •4.Вопрос 1 Формирование электронной оболочки атома
- •4.2 Основные закономерности заполнения электронами уровней, подуровней и орбиталей в электронной оболочке атома
- •5 Общие представления о химической связи
- •5.2. Квантово-механическая теория химической связи
- •Типы химических связей и их свойства.
- •Параметры химической связи
- •7 Вопрос: Понятие химическое вещество и химическая реакция. Основные типы химических реакций.
- •8 Вопрос: Классификация химических реакций.
- •I. В зависимости от механизма реакции могут быть отнесены к простым и сложным.
- •II. По признаку изменения числа исходных и конечных веществ реакции можно выделить такие типы:
- •10 Вопрос
- •1 Понятие химического равновесия
- •2. Скорость химической реакции.
- •3. Константа равновесия
- •12 Вопрос: Смещение химического равновесия. Принцип Ле Шателье. Основныепричины смещения химического равновесия.
- •1 Изменение концентрации какого-либо из исходных веществ, участвующих в реакции (температура и давление постоянны):
- •14 Вопрос
- •Факторы, влияющие на скорость химической реакции
- •2.1 Зависимость скорости реакции от природы реагирующих веществ
- •2.2 Зависимостьскорости реакции от концентрации реагирующих веществ
- •2.3 Зависимостьскорости реакции от температуры
- •2.4 Зависимость скорости реакции от присутствия катализаторов.
- •15 Вопрос: Основные положения теории электролитической диссоциации.Истинные и потенциальные электролиты
- •2) Гидратация этих ионов.
- •16 Вопрос: Степень диссоциации. Константа диссоциации. Ионные реакции
- •17 Вопрос
- •18 Вопрос: Гидролиз солей. Степень гидролиза. Константа гидролиза
- •Гидролиз солей, соответствующих сильному основанию и слабой кислоте
- •Гидролиз солей, соответствующих слабому основанию и сильной кислот
- •19 Вопрос: Окислительно-востановительные реакции. Понятие окисления, восстановления, окислитель, восстановитель.
- •20 Вопрос: Типы овр. Типичные окислители и восстановители.
- •21Вопрос: Составление уравнений овр(м-д электронного баланса,м-д полуреакций)
- •22 Вопрос
- •Предмет органической химии
- •1.Многочисленность органических соединений по сравнению с неорганическими соединениями.
- •Первые теоретические воззрения
- •Теория строения а.М.Бутлерова
- •23 Вопрос
- •1. Тривиальная номенклатура
- •2 4 Вопрос
- •Общая характеристика: строение, классификация, номенклатура
- •25 Вопрос
20 Вопрос: Типы овр. Типичные окислители и восстановители.
Типы ОВР:
1. Межмолекулярные ОВР - это реакции, которые идут с изменением степени окисления атомов в молекулах разных веществ:
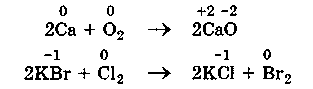
ОВР такого типа встречаются чаще всего.
2. Внутримолекулярные ОВР - это реакции, которые идут с изменением степени окисления разных атомов в одной молекуле. При этом атом элемента с более высокой степенью окисления является окислителем и окисляет атом элемента с меньшей степенью окисления.
Например:

3.Реакции диспропорционирования (дисмутации) - это реакции, которые идут с изменением степени окисления одинаковых атомов в молекуле (или молекулах) одного и того же вещества.
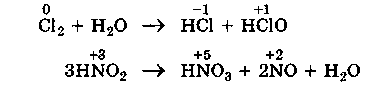
4.Реакции конпропорционирования (конмутации) — это реакции, обратные реакциям диспропорционирования. В результате этих реакций атомы одного элемента, находящиеся в разных степенях окисления, переходят к общей степени окисления, промежуточной между исходными степенями.
Реакции конпропорционирования могут быть как:
─ межмолекулярными
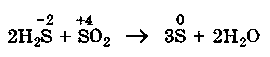
─ ![]() так
и внутримолекулярными
так
и внутримолекулярными
Реакции диспропорционирования и конпропорционирования иногда объединяют общим названием реакции самоокисления-самовосстановления.
В качестве типичных окислителей могут выступать:
1) простые вещества, образуемые атомами с большой электроотрицательностью, т. е. типичные неметаллы, расположенные, прежде всего, в главных подгруппах шестой и седьмой групп периодической системы;
2) вещества, содержащие элементы в высших и промежуточных положительных степенях окисления, в том числе в виде ионов, как простых, элементарных (Fе3+), так и кислородсодержащих, оксоанионов (перманганат-ион);
3) перекисные соединения (пероксиды, супероксиды и т. д.);
4) Кислородсодержащие анионы, содержащие атом неметалла в высшей положительной степени окисления (SO4 (степень окисления серы +6), NO3 (степень окисления азота +5)
В качестве типичных восстановителей могут выступать:
1) простые вещества, атомы которых имеют низкую электроотрицательность («активные» металлы);
2) катионы металлов в низших степенях окисления (Fе2+);
3) простые, элементарные анионы, например сульфид-ион;
4) кислородсодержащие анионы (оксоанионы), соответствующие низшим положительным степеням окисления элемента (нитрит, сульфит);
5) катод электролизной ячейки.
21Вопрос: Составление уравнений овр(м-д электронного баланса,м-д полуреакций)
Метод электронного баланса (окислительных чисел) рассмотрим на примере реакции
![]()
Для расстановки коэффициентов выполняем следующие действия.
1. Определяем элементы, атомы которых изменяют степень окисления:
![]()
2. Находим окислитель и восстановитель в данной ОВР и пишем отдельно электронные уравнения процессов окисления и восстановления:
3. Уравниваем число электронов в процессе окисления и восстановления (электронный баланс):
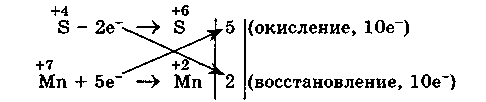
4. Коэффициенты 5 и 2 из электронных уравнений переносим в молекулярное уравнение ОВР:
![]()
5. Окончательно уравниваем число атомов каждого элемента в обеих частях молекулярного уравнения:
![]()
Mетод полуреакций (ионно-молекулярный метод) основан на составлении уравнений процессов окисления и восстановления с помощью ионов и молекул, реально существующих в растворе. Сильные электролиты записывают в виде ионов, а слабые электролиты, газы и малорастворимые вещества - в виде молекул.


Теперь уравниваем число электронов в полуреакциях окисления и восстановления и получаем» сокращенное ионно молекулярное уравнение ОВР:Записываем молекулярное уравнение ОВР: