
- •1). Интерференция световых волн. Когерентность световых волн. Условие максимума и минимума для интерференции света. Оптическая длина пути.
- •5). Кольца Ньютона. Способ их наблюдения. Радиусы колец.
- •6). Интерферометры. Интерферометр Майкельсона. Применение интерферометров.
- •7). Дифракция света. Принцип Гюйгенса и Гюйгенса-Френеля. Метод зон Френеля. Прямолинейное распространение света.
- •8). Дифракция Френеля на круглом отверстии:
- •9). Дифракция Фраунгофера на одной щели.
- •10). Дифракционная решетка. Дифракционная картина от решетки. Главные максимумы и минимумы.
- •11). Дифракционная решетка как спектральный прибор. Угловая и линейная дисперсия. Разрешающая способность.
- •3. 7. Дисперсия и разрешающая сила спектрального прибора. @
- •12). Дифракция рентгеновских лучей на пространственной решетке кристаллов. Формула Вульфа- Брегга. Изучение структуры кристаллов.
- •13). Понятие о голографии. Получение и восстановление голографических снимков. Особенности голографического снимка.
- •14). Поляризация света. Естественный и поляризованный свет. Частичная и полная плоская поляризация света.
- •15). Прохождение света через поляризатор и анализатор. Закон Малюса.
- •16). Поляризация света при отражении. Закон Брюстера.
- •17). Поляризация света при двойном лучепреломлении. Обыкновенный и необыкновенные лучи. Причина их возникновения. Одноосные и двуосные кристаллы.
- •18). Призма Николя. Оптический дихроизм. Поляризационные призмы и поляроиды.
- •19). Вращение плоскости поляризации света. Оптически активные вещества.
- •20). Магнитное вращение плоскости поляризации
- •21). Искусственная оптическая поляризация. Эффект Керра и Коттона- Мутона.
- •22). Поглощение света при прохождении через вещество. Механизм поглощения.
- •23). Рассеяние света в веществе.
- •24). Дисперсия света в веществе. Нормальная и аномальная дисперсия. Объяснение дисперсии света.
- •25). Эффект Вавилова- Черенкова.
- •26). Тепловое излучение. Основные характеристики теплового излучения. Равновесный характер теплового излучения.
- •27). Связь между лучеиспускательной и поглащательной способностями тел. Закон Кирхгофа. Абсолютно-чёрное тело.
- •28). Распределение световой энергии в спектре абсолютно- черного тела. Серые тела.
- •29). Теория Релея и Джинса. Затруднения классической теории излучения.
- •31). Внешний фотоэффект как квантовое явление и его законы. Применение фотоэффекта.
- •32). Фотон и его свойства. Энергия,импульс,масса и скорость фотона.
- •33). Давление света. Опыты Лебедева.
- •34). Эффект Комптона и его теория.
- •35). Корпускулярно-волновой дуализм. Соотношение между волновыми и корпускулярными свойствами света.
- •36). Спектральные серии в спектре излучения атома водорода.
- •37). Опыты Резерфорда. Планетарная модель атома. Её устойчивость.
- •38). Постулаты Бора. Условие квантования орбит.
- •39). Теория Бора для водородоподобного атома, её ограниченность.
- •40). Гипотеза де Бройля,её опытное подтверждение. Волновые свойства микрочастиц.
- •41). Соотношение неопределённостей как следствие корпускулярно-волновых свойств вещества.
- •42). Волновая функция. Её статистический смысл. Свойства волновой функции.
- •43). Общее уравнение Шредингера. 44). Уравнение Шредингера для стационарных состояний. Свободная частица.
- •45). Частица в одномерной потенциальной яме. Квантование энергии.
- •46). Туннельный эффект.
- •47). Уравнение Шредингера для атома водорода и его решение. 48). Квантовые числа.Вырожденные состояния.Обозначения состояний атома.Правила отбора.
- •49). Мультиплетность спектральных линий. Спин электрона. Спиновое квантовое число.
- •50). Принцип Паули. Распределение электронов в атоме по состояниям.
- •51). Периодическая система элементов д.И. Менделеева. Принципы её построения.
- •52. Спонтанное и вынужденное излучения атомов,их особенности. Инверсные состояния атомов.
- •53). Мазеры,лазеры,принцип их действия.
- •54 Вопрос! а) Размер, состав и заряд атомного ядра. Массовое и зарядовое числа. Изотопы
- •Б) дефект массы и энергия связи ядра
- •В) Закономерности a-распада, б-распад ниже
- •В) ядерные реакции и их основные типы
- •Г) реакция деления ядра
- •Д) цепная реакция деления
49). Мультиплетность спектральных линий. Спин электрона. Спиновое квантовое число.
Мультиплетность определяет кратность вырождения уровней атома или молекулы. 2S + 1 квантовых состояний, соответствующих уровню энергии с заданным S, отличаются значениями проекции полного спина и характеризуются квантовым числом Ms = S, S — 1,..., —S, определяющим величину этой проекции. Вследствие спин-орбитального взаимодействия уровень энергии может расщепиться на c = 2S + 1 подуровней (мультиплетное расщепление, приводящее к расщеплению спектральных линий, см. Тонкая структура). Значения Мультиплетность для квантовых состояний атомов и молекул определяются электронами в незамкнутых оболочках, т. к. в заполненных оболочках спины электронов компенсируются. Для уровней энергии щелочных металлов с 1 внешним электроном c = 2, как и для атома Н; для уровней энергии сложных атомов с заполняющимися p-, d- и f-оболочками Мультиплетность могут быть высокими (до 11). Для Химически устойчивых молекул, имеющих, как правило, чётное число электронов, характерны Мультиплетность c = 1 для основного и c = 1 и 3 для возбуждённых уровней энергии; для свободных радикалов с одним электроном с некомпенсированным спином типична Мультиплетность c = 2.
Мультиплетность -число возможных ориентаций в пространстве полного спина атома или молекулы. Согласно квантовой механике, Мультиплетность c = 2S + 1, где S — спиновое квантовое число.Для N электронов максимальная Мультиплетность (c = N + 1) соответствует параллельному направлению их спинов.
Спин электрона (и всех других микрочастиц) - квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Если
электрону приписывается собственный
механический момент импульса (спин) Ls,
то ему соответствует собственный
магнитный момент pms. Согласно общим
выводам квантовой механики, спин
квантуется по закону![]() где
s - спиновое квантовое число.
где
s - спиновое квантовое число.
По
аналогии с орбитальным моментом импульса,
проекция La спина квантуется так, что
вектор L, может принимать 2s + 1 ориентации.
Так как в опытах Штерна и Герлаха
наблюдались только две ориентации, то
2s+1=2, откуда s = ½. Проекция спина на
направление внешнего магнитного поля,
являясь квантованной величиной,
определяется выражением, аналогичным
(223.6):
![]() где
ms
- магнитное спиновое квантовое число;
оно может иметь только два значения: ms
= ± 1/2
где
ms
- магнитное спиновое квантовое число;
оно может иметь только два значения: ms
= ± 1/2
Таким образом, опытные данные привели к необходимости характеризовать электроны (и микрочастицы вообще) добавочной внутренней степенью свободы. Поэтому для полного описания состояния электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число.
50). Принцип Паули. Распределение электронов в атоме по состояниям.
Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Отсюда следует, что два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметричной. Обобщая опытные данные, В. Паули сформулировал принцип, согласно которому системы фермионов встречаются в природе только в состояниях, описываемых антисимметричными волновыми функциями (квантово-механическая формулировка принципа Паули).
Из этого положения вытекает более простая формулировка принципа Паули, которая и была введена им в квантовую теорию (1925) еще до построения квантовой механики: в системе одинаковых фермионов любые два из них не могут одновременно находиться в одном и том же состоянии. Отметим, что число однотипных бозонов, находящихся в одном и том же состоянии, не лимитируется.
Напомним, что состояние электрона в атоме однозначно определяется набором четырех квантовых чисел:
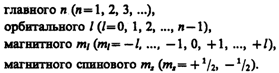
Распределение электронов в атоме подчиняется принципу Паули, который может быть использован в его простейшей формулировке: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел п, l, ml и тs т. е.
![]()
где Z(п, l, ml, тs) — число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел: п, l, ml, тs. Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Согласно формуле (223.8), данному n соответствует n2 различных состояний, отличающихся значениями l и ml. Квантовое число тs может принимать лишь два значения (± ½). Поэтому максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом, равно
![]()
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой. В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l. Поскольку орбитальное квантовое число принимает значения от 0 до n–1, число подоболочек равно порядковому номеру n оболочки. Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в подоболочке с данным l равно 2(2l+1).
