
- •1). Интерференция световых волн. Когерентность световых волн. Условие максимума и минимума для интерференции света. Оптическая длина пути.
- •5). Кольца Ньютона. Способ их наблюдения. Радиусы колец.
- •6). Интерферометры. Интерферометр Майкельсона. Применение интерферометров.
- •7). Дифракция света. Принцип Гюйгенса и Гюйгенса-Френеля. Метод зон Френеля. Прямолинейное распространение света.
- •8). Дифракция Френеля на круглом отверстии:
- •9). Дифракция Фраунгофера на одной щели.
- •10). Дифракционная решетка. Дифракционная картина от решетки. Главные максимумы и минимумы.
- •11). Дифракционная решетка как спектральный прибор. Угловая и линейная дисперсия. Разрешающая способность.
- •3. 7. Дисперсия и разрешающая сила спектрального прибора. @
- •12). Дифракция рентгеновских лучей на пространственной решетке кристаллов. Формула Вульфа- Брегга. Изучение структуры кристаллов.
- •13). Понятие о голографии. Получение и восстановление голографических снимков. Особенности голографического снимка.
- •14). Поляризация света. Естественный и поляризованный свет. Частичная и полная плоская поляризация света.
- •15). Прохождение света через поляризатор и анализатор. Закон Малюса.
- •16). Поляризация света при отражении. Закон Брюстера.
- •17). Поляризация света при двойном лучепреломлении. Обыкновенный и необыкновенные лучи. Причина их возникновения. Одноосные и двуосные кристаллы.
- •18). Призма Николя. Оптический дихроизм. Поляризационные призмы и поляроиды.
- •19). Вращение плоскости поляризации света. Оптически активные вещества.
- •20). Магнитное вращение плоскости поляризации
- •21). Искусственная оптическая поляризация. Эффект Керра и Коттона- Мутона.
- •22). Поглощение света при прохождении через вещество. Механизм поглощения.
- •23). Рассеяние света в веществе.
- •24). Дисперсия света в веществе. Нормальная и аномальная дисперсия. Объяснение дисперсии света.
- •25). Эффект Вавилова- Черенкова.
- •26). Тепловое излучение. Основные характеристики теплового излучения. Равновесный характер теплового излучения.
- •27). Связь между лучеиспускательной и поглащательной способностями тел. Закон Кирхгофа. Абсолютно-чёрное тело.
- •28). Распределение световой энергии в спектре абсолютно- черного тела. Серые тела.
- •29). Теория Релея и Джинса. Затруднения классической теории излучения.
- •31). Внешний фотоэффект как квантовое явление и его законы. Применение фотоэффекта.
- •32). Фотон и его свойства. Энергия,импульс,масса и скорость фотона.
- •33). Давление света. Опыты Лебедева.
- •34). Эффект Комптона и его теория.
- •35). Корпускулярно-волновой дуализм. Соотношение между волновыми и корпускулярными свойствами света.
- •36). Спектральные серии в спектре излучения атома водорода.
- •37). Опыты Резерфорда. Планетарная модель атома. Её устойчивость.
- •38). Постулаты Бора. Условие квантования орбит.
- •39). Теория Бора для водородоподобного атома, её ограниченность.
- •40). Гипотеза де Бройля,её опытное подтверждение. Волновые свойства микрочастиц.
- •41). Соотношение неопределённостей как следствие корпускулярно-волновых свойств вещества.
- •42). Волновая функция. Её статистический смысл. Свойства волновой функции.
- •43). Общее уравнение Шредингера. 44). Уравнение Шредингера для стационарных состояний. Свободная частица.
- •45). Частица в одномерной потенциальной яме. Квантование энергии.
- •46). Туннельный эффект.
- •47). Уравнение Шредингера для атома водорода и его решение. 48). Квантовые числа.Вырожденные состояния.Обозначения состояний атома.Правила отбора.
- •49). Мультиплетность спектральных линий. Спин электрона. Спиновое квантовое число.
- •50). Принцип Паули. Распределение электронов в атоме по состояниям.
- •51). Периодическая система элементов д.И. Менделеева. Принципы её построения.
- •52. Спонтанное и вынужденное излучения атомов,их особенности. Инверсные состояния атомов.
- •53). Мазеры,лазеры,принцип их действия.
- •54 Вопрос! а) Размер, состав и заряд атомного ядра. Массовое и зарядовое числа. Изотопы
- •Б) дефект массы и энергия связи ядра
- •В) Закономерности a-распада, б-распад ниже
- •В) ядерные реакции и их основные типы
- •Г) реакция деления ядра
- •Д) цепная реакция деления
38). Постулаты Бора. Условие квантования орбит.
Для преодоления противоречий между ядерной моделью атома Резерфорда и законами классической электродинамики Нильс Бор поставил перед собой цель связать в единое целое ядерную модель атома Резерфорда, закономерности линейчатых спектров и квантовый характер излучения и поглощения света. В 1913 г. он предложил квантовую модель атома, в основу которой положил следующие постулаты.
1 постулат Бора (постулат стационарных состояний): электрон в атоме может находиться только в особых стационарных (квантовых) состояниях, каждому из которых соответствует определенная энергия. Когда электрон находится в стационарном состоянии, атом не излучает. Стационарные состояния отличаются друг от друга различными орбитами, по которым движутся электроны в атоме. Набор электронных орбит, по сути, и определяет стационарные состояния электрона в атоме. Как следует из постулата, вопреки классической электродинамике электроны движутся по замкнутым орбитам и электромагнитные волны при этом не излучаются. Стационарные состояния можно пронумеровать, присвоив им порядковый номер n=1, 2, 3, ..., причем каждое состояние обладает своей фиксированной энергией Еn.
Первый постулат Бора сохраняет основу ядерной модели атома, предложенной Резерфордом: электроны вращаются вокруг ядра по определенным (разрешенным) орбитам. Бор полагал, что эти орбиты представляют собой окружности, однако немецкий физик Арнольд Зоммерфельд показал, что орбиты могут также иметь форму эллипса, причем ядро располагается в одном из его фокусов.
2 постулат Бора (правило частот): электрон в атоме может «скачком» переходить из одного стационарного состояния (k-катого) в другое (п-энное). При этом переходе испускается или поглощается квант электромагнитного поля с частотой vkn, определяемой разностью энергий электрона в атоме в данных состояниях:
Ekn=hνkn=Ek -En; νkn=( Ek -En)/h
Если Ек>Еn, то происходит излучение энергии, если Ek<En — ее поглощение.
Состояние атома, которому соответствует наименьшая энергия, называется основным, а состояния, которым соответствуют большие значения энергии,— возбужденными. Впоследствии было показано, что в основном энергетическом состоянии электрон в атоме может находиться неограниченно долго, а в остальных стационарных состояниях — в среднем не более ~10-8 с. Это так называемое время жизни атома в возбужденном состоянии.
Как следует из II постулата Бора, частота излучения атома не снизана с частотой обращения электрона по орбите, а определяется энергиями Ek и Еn атома в начальном и конечном состояниях. Переход электрона в атоме из одного стационарного состояния в другое сопровождается электромагнитным излучением с длиной волны.
Правило частот Бора позволило объяснить линейчатую структуру атомных спектров: частоты излучения атома определяются значениями энергий атома в возбужденных состояниях.
Третий постулат Н. Бора определяет правила квантования стационарных орбит. Бор предположил, что момент импульса электрона, вращающегося на стационарной орбите в атоме водорода, может принимать только дискретные значения, кратные постоянной Планка. Для круговых орбит правило квантования Бора записывается в виде:
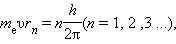
где me – масса электрона, υ – его орбитальная скорость, rn – радиус n-ой стационарной орбиты. Целое число n называется квантовым числом.
Правило квантования орбит по Бору получило наглядную интерпретацию в теории де Бройля, высказавшего гипотезу о наличии у электрона волновых свойств .Согласно де Бройлю электрону (и любому другому микрообъекту) соответствует волновой процесс с длиной волны
![]() где
p – импульс электрона.
где
p – импульс электрона.
Таким образом, Бор усовершенствовал ядерную (планетарную) модель атома Резерфорда и объяснил вид атомных спектров и квантовый характер излучения, обнаруженный Планком и Эйнштейном.
Это был следующий шаг в становлении новой, квантовой, физики.
