
- •1. Чистые вещества и смеси. Разделение смесей.
- •2. Соляная кислота. Получение. Химические свойства соляной кислоты.
- •1. Закон постоянства состава вещества. Закон сохранения массы вещества.
- •2. Соединения натрия. Способы получения соединений натрия
- •1. Количество вещества. Закон Авогадро.
- •2. Щелочные металлы. Общая характеристика. Химические свойства
- •1. Типы химических реакций.
- •2. Химические свойства водорода.
- •1. Общая характеристика кислорода. Получение кислорода
- •2. Генетическая связь между классами неорганических соединений.
- •1.Окисление. Оксиды. Классификация оксидов. Получение.
- •Основные оксиды:
- •2. Электроотрицательность химических элементов
- •1. Закон Авогадро. Молярный объем газа. Относительная плотность
- •Относительная плотность газа — это отношение молярной массы данного газа к молярной массе того газа, по которому она находится.
- •2. Химические свойства и применение галогенов.
- •1.Водород. Общая характеристика. Получение
- •2. Ковалентная связь, классификация, образование.
- •1. Кислоты. Классификация. Способы получения.
- •2. Типы кристаллических решеток.
- •1. Химические свойства кислот.
- •2. Типы кристаллических решеток.
- •2.Степень окисления. Окислительно-восстановительные реакции.
- •1. Вода: состав, физические и химические свойства. Растворимость.
- •2.Химические свойства и получение хлора.
- •1. Горение. Тепловой эффект. Термохимические реакции.
- •2. Общая характеристика подгруппы галогенов. Положение галогенов в периодической таблице, способы получения.
- •1. Аллотропия. Дать характеристику аллотропным изменениям.
- •2. Химические свойства оксидов. Основные оксиды
- •1. Основания. Классификация. Способы получения.
- •2. Концентрация растворов. Массовая доля растворенного вещества.
- •1. Химические свойства оснований.
- •2. Движение электронов в атомах.
- •1. Соли. Классификация. Способы получения.
- •2. Химическая формула вещества.
- •1. Химические свойства солей.
- •2.Характеристика химических элементов и их соединений на основе положения в периодической системе.
- •1. Химическая связь между классами неорганических соединений.
- •2. Структура Периодической системы химических элементов.
- •1. Периодический закон д.И.Менделеева. Семейства элементов и их свойства.
- •2. Химические свойства кислорода.
- •1. Строение атома. Изотопы.
- •2. Химические свойства галогенов.
1. Основания. Классификация. Способы получения.
Основания - это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами - ОН.Общая формула:
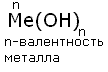
По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента:
Формула |
Название |
Формула |
Название |
LiOH |
гидроксид лития |
Ca(OH)2 |
гидроксид кальция |
NaOH |
гидроксид натрия |
Cu(OH)2 |
гидроксид меди(II) |
KOH |
гидроксид калия |
Fe(OH)3 |
гидроксид железа(III) |
Классификация оснований
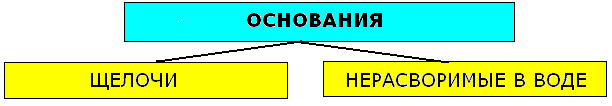
Щёлочи – это основания растворимые в воде. К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные - нерастворимые. К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью -как кислоты.
Классификация оснований по числу групп ОН:
n=1 однокислотное n=2 двухкислотное n=3 трехкислотное
Способы получения:
Металл + H2O = ЩЁЛОЧЬ + Н2↑
2Na + 2H2O = 2NaOH + H2
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba, Ra)
ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ
Na2O + H2O = 2 NaOH
Здесь, ОКСИД МЕТАЛЛА – щелочного металла (Li, Na, K, Rb, Cs) или щелочноземельного (Ca, Ba, Ra)
НЕРАСТВОРИМЫХ ОСНОВАНИЙ
СОЛЬ + ЩЁЛОЧЬ = новое ОСНОВАНИЕ + новая СОЛЬ
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
2. Концентрация растворов. Массовая доля растворенного вещества.
Концентрация раствора - это отношение количества растворенного вещества к количеству раствора. В зависимости от количества растворимого вещества растворы бывают концентрированными , разбавленными . Массовой долей растворенного вещества к общей массе раствора . Можно приготовить растворы с различной массовой долей . Массовая доля широко применяется при решении различных задач.
Билет №16
1. Химические свойства оснований.
Взаимодействие оснований с кислотами:
основание + кислота = соль + вода
NaOH + HCI =NaCl + H2O
Cu(OH)2 + 2HCI = CuCl2 + 2H2O
Взаимодействие щелочей с кислотными оксидам :
щелочь + кислотный оксид = соль + вода
C a(OH)2 + CO2 = CaCO3 +H2O
Взаимодействие щелочей с солями :
щелочь + соль = нерастворимое основание + соль
2 NaOH + CuSO4 = Cu (OH)2 + Na2SO4
2. Движение электронов в атомах.
Согласно закономерностям микромира , электроны атома , чаще пребывая в определенном пространстве , образуют электронное облако вокруг его ядра . Исходя из форм электронных облаков , различают s- и p- орбитали . В каждом электронном слое имеются определенные орбитали . В зависимости от пространственного расположения в электроном слое имеются одна s , три
p- орбитали , в каждой из которых могут вместиться 2 электрона .Электронное строение молекул можно лаконично изобразить в виде электронных формул.
Билет №17
