
- •1. Чистые вещества и смеси. Разделение смесей.
- •2. Соляная кислота. Получение. Химические свойства соляной кислоты.
- •1. Закон постоянства состава вещества. Закон сохранения массы вещества.
- •2. Соединения натрия. Способы получения соединений натрия
- •1. Количество вещества. Закон Авогадро.
- •2. Щелочные металлы. Общая характеристика. Химические свойства
- •1. Типы химических реакций.
- •2. Химические свойства водорода.
- •1. Общая характеристика кислорода. Получение кислорода
- •2. Генетическая связь между классами неорганических соединений.
- •1.Окисление. Оксиды. Классификация оксидов. Получение.
- •Основные оксиды:
- •2. Электроотрицательность химических элементов
- •1. Закон Авогадро. Молярный объем газа. Относительная плотность
- •Относительная плотность газа — это отношение молярной массы данного газа к молярной массе того газа, по которому она находится.
- •2. Химические свойства и применение галогенов.
- •1.Водород. Общая характеристика. Получение
- •2. Ковалентная связь, классификация, образование.
- •1. Кислоты. Классификация. Способы получения.
- •2. Типы кристаллических решеток.
- •1. Химические свойства кислот.
- •2. Типы кристаллических решеток.
- •2.Степень окисления. Окислительно-восстановительные реакции.
- •1. Вода: состав, физические и химические свойства. Растворимость.
- •2.Химические свойства и получение хлора.
- •1. Горение. Тепловой эффект. Термохимические реакции.
- •2. Общая характеристика подгруппы галогенов. Положение галогенов в периодической таблице, способы получения.
- •1. Аллотропия. Дать характеристику аллотропным изменениям.
- •2. Химические свойства оксидов. Основные оксиды
- •1. Основания. Классификация. Способы получения.
- •2. Концентрация растворов. Массовая доля растворенного вещества.
- •1. Химические свойства оснований.
- •2. Движение электронов в атомах.
- •1. Соли. Классификация. Способы получения.
- •2. Химическая формула вещества.
- •1. Химические свойства солей.
- •2.Характеристика химических элементов и их соединений на основе положения в периодической системе.
- •1. Химическая связь между классами неорганических соединений.
- •2. Структура Периодической системы химических элементов.
- •1. Периодический закон д.И.Менделеева. Семейства элементов и их свойства.
- •2. Химические свойства кислорода.
- •1. Строение атома. Изотопы.
- •2. Химические свойства галогенов.
Ответы на билеты по химии.
Билет №1
1. Чистые вещества и смеси. Разделение смесей.
Вещество - это то, из чего состоит тело .
Смеси включают в себя два или более вещества.
Смеси:
Однородные
Неоднородные
В однородных смесях , в отличие от неоднородных , отдельные частицы не обнаруживаются . В смесях вещества сохраняют свои индивидуальные свойства .
Существует два способа разделения смесей :
Отстаивание - если твердые частицы имеют большую плотность , то после отстаивания , те частицы которые имеют плотность больше воды осядут , а те что имеют меньшую всплывут .
Фильтрование - механическая операция отделения твердого вещества от жидкого при помощи пропускания исходной смеси через пористую пластину, через которую может пройти только жидкость.
2. Соляная кислота. Получение. Химические свойства соляной кислоты.
Солняная кислота — HCl, раствор хлороводорода в воде; сильная одноосновная кислота. Бесцветная «дымящая» на воздухе, едкая жидкость. Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см³. Молярная масса 36,46 г/моль.
Соли соляной кислоты называются хлоридами.
Химические свойства :
Соляная кислота имеет специфическое свойство . Если к соляной кислоте и ее солям добавить раствор нитрата серебра , образуется белый осадок хлорида серебра :
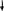 HCL+AgNO3
= HNo3+AgCl
HCL+AgNO3
= HNo3+AgCl
П
 ри
взаимодействии соляной кислоты с
активными металлами , с основными
оксидами и основаниями образуются
хлориды. Например, при взаимодействии
с металлами
ри
взаимодействии соляной кислоты с
активными металлами , с основными
оксидами и основаниями образуются
хлориды. Например, при взаимодействии
с металлами
Fe+2HCL = FeCl3 +H2
Взаимодействие с основными оксидом :
FeO+2HCL = FeCl2+H2O
Взаимодействие с нерастворимыми основаниями :
Fe(OH)2 + 2HCL = FeCl2+2H2O
Получение:
При темпиратуре 400 С и избытке поваренной соли возможно вхаимодействие:
2NaCl+H2So4 =Na2So4+ 2HCL - гидросульфат натрия
Е сли нагреть до 700 С образуется срелняя соль - сульфат натрия :
NaHSO4+NaCl=Na2So4+HCL
В промышленности хлороводород в виде газа получают прямым взаимодействием водорода и хлора :
H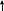 2+Cl2=2HCL
2+Cl2=2HCL
Билет №2.
1. Закон постоянства состава вещества. Закон сохранения массы вещества.
Закона постоянства состава вещества:
Каким бы способом ни было получено вещество, его химический состав и свойства остаются неизменными.
(Закон был установлен в 1799 году французским химиком Ж.-Л. Прустом на основании анализа многих химических соединений, для которых состав и свойства оставались постоянными независимо от времени, места и способа их получения.)
Закон сохранения массы
Современная формулировка закона сохранения массы веществ (был установлен русским ученым М.В. Ломоносовым и французским ученым А. Лоран-де-Лавуазье):
Суммарная масса реагентов равна суммарной массе продуктов реакции.
На атомно-молекулярном уровне закон сохранения массы объясняется тем, что при течении химической реакции происходит только перегруппировка атомов реагентов в молекулы продуктов. Число же атомов каждого элемента и масса каждого атома остаются неизменными до и после реакции.
