- •Кафедра общей и физической химии Физическая химия Фазовые диаграммы
- •Введение
- •1. Основные понятия и определения
- •2. Диаграммы состояния однокомпонентных (унарных) систем
- •Р ис. 3. Наклон кривых фазовых переходов в зависимости от соотношения плотностей фаз:
- •2.1. Типы полиморфных превращений
- •3. Фазовые равновесия в двухкомпонентных системах
- •3.1. Общие понятия и определения
- •3.1.1. Правило рычага
- •3.2. Фазовые равновесия в двухкомпонентных системах жидкость – жидкость и жидкость – пар
- •3.2.1. Характеристика двухкомпонентных систем
- •3.2.2. Типовые диаграммы неконденсированных систем
- •3.2.2.1. Диаграммы состояния неконденсированных систем с неограниченной растворимостью в жидком состоянии
- •3.2.2.2. Диаграммы состояния неконденсированных систем с ограниченной взаимной растворимостью компонентов в жидком состоянии
- •3.2.3. Общие рекомендации по решению задач
- •3.3. Фазовые равновесия в конденсированных двухкомпонентных системах
- •3.3.1. Краткие теоретические сведения
- •3.3.2. Типовые диаграммы состояния двухкомпонентных конденсированных систем
- •3 .3.2.1. Простейшая диаграмма состояния двухкомпонентной конденсированной системы
- •3.3.2.2. Диаграмма состояния двухкомпонентной конденсированной системы с полиморфным превращением одного из компонентов
- •3.3.2.3. Диаграмма состояния двухкомпонентной конденсированной системы с ограниченной растворимостью компонентов в жидком состоянии
- •3.3.2.4. Диаграмма состояния двухкомпонентной конденсированной системы с неограниченной растворимостью компонентов в твердом состоянии
- •3.3.2.5. Диаграмма состояния двухкомпонентной конденсированной системы с ограниченной растворимостью компонентов в твердом состоянии
- •3.3.2.6. Диаграмма состояния двухкомпонентной конденсированной системы с твердым раствором и полиморфным превращением
- •3.3.2.7. Диаграмма состояния двухкомпонентной конденсированной системы с одним химическим соединением, плавящимся без разложения (конгруэнтно)
- •3.3.2.8. Диаграмма состояния двухкомпонентной конденсированной системы с одним химическим соединением, плавящимся с разложением (инконгруэнтно)
- •3.3.2.9. Диаграмма состояния двухкомпонентной конденсированной системы с образованием химического соединения с переменным составом (бертоллида)
- •3.3.3. Последовательность расшифровки диаграммы состояния двухкомпонентной конденсированной системы
- •3.3.4. Пример решения задачи Пример 4. Прочесть диаграмму состояния системы «медь – магний» (рис. 39).
- •3.3.5. Построение диаграмм состояния двухкомпонентных систем
- •3.3.5.1. Построение диаграмм состояния по экспериментальным данным
- •3.3.5.2. Построение диаграмм состояния двухкомпонентных конденсированных систем по заданной характеристике компонентов
- •4. Фазовые равновесия в трехкомпонентных конденсированных системах
- •4.1. Общие теоретические сведения
- •4.1.1. Треугольник Гиббса
- •4.1.2. Треугольник Розебома
- •4.1.3. Правило луча
- •4.1.4. Сечения объемной диаграммы при заданной температуре
- •4.1.5. Применение правила рычага для трехкомпонентных систем
- •4.1.6. Проекция нескольких сечений на концентрационный треугольник
- •4.2. Типовые диаграммы состояния трехкомпонентных конденсированных систем
- •4.2.1. Диаграмма состояния трехкомпонентной конденсированной системы без химических соединений и полиморфных превращений
- •4.2.2. Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся без разложения
- •4.2.3. Диаграмма состояния трехкомпонентной конденсированной системы с одним химическим соединением, плавящимся с разложением (инконгруэнтно)
- •4.2.4. Диаграмма состояния трехкомпонентной конденсированной системы с одним тройным химическим соединением, плавящимся без разложения
- •4.2.5. Диаграмма состояния трехкомпонентной конденсированной системы с двумя двойными химическими соединениями, плавящимися без разложения
- •4.2.6. Диаграмма состояния трехкомпонентной конденсированной системы с тремя двойными химическими соединениями, плавящимися без разложения
- •4.2.7. Диаграмма состояния трехкомпонентной конденсированной системы с двумя тройными и тремя двойными химическими соединениями, плавящимися без разложения
- •4.2.8. Диаграмма состояния системы SiO2-Al2o3-CaO
- •4.2.9. Порядок рассмотрения трехкомпонентной диаграммы состояния конденсированной системы
- •4.2.10. Пример расчета диаграммы п ример 6. Прочесть диаграмму состояния системы (рис. 60).
- •4.3. Трехкомпонентные водно-солевые системы
- •4.3.1. Общие теоретические сведения
- •4.3.2. Диаграмма растворимости в воде двух солей с одноименным ионом
- •4.3.3. Диаграмма растворимости двух солей с одноименным ионом и образованием двойной соли
- •4.3.4. Диаграмма растворимости двух солей с одноименным ионом и образованием кристаллогидрата одной из солей
- •4.3.5. Диаграмма растворимости двух солей с одноименным ионом и образованием кристаллогидрата двойной соли
- •4.3.6. Порядок рассмотрения трехкомпонентной диаграммы состояния водно-солевой системы
- •4.3.7. Пример расчета диаграммы Пример 7. Описать диаграмму состояния трехкомпонентной водно-солевой системы с одноименным ионом (рис. 69).
4.1.5. Применение правила рычага для трехкомпонентных систем
Относительное количество фаз в точке заданного состава определяется по правилу рычага. Правило рычага применимо к плоским диаграммам состояния трехкомпонентных систем, т.к. любое поле такой диаграммы содержит не более двух фаз. Для определения относительного количества фаз следует выбрать точку на диаграмме состояния и от «хозяина поля» провести ноду или луч через заданную точку (рис. 49).
Р ис.
49. Применение правила рычага.
ис.
49. Применение правила рычага.
Точка пересечения с линией поля диаграммы покажет состав жидкой фазы. Пока идет кристаллизация «хозяина поля» соотношение концентраций двух других компонентов будет оставаться величиной постоянной. Количество жидкой фазы определяется длиной отрезка [An]; количество твердого вещества – длиной отрезка [mn]:
![]() ;
;
![]() .
.
4.1.6. Проекция нескольких сечений на концентрационный треугольник
Для изображения на плоскости проекции нескольких сечений и температурного рельефа диаграммы используется метод, аналогичный применяемому в топографии для изображения рельефа местности на картах. С этой целью выполняют сечения объемной диаграммы изотермическими плоскостями, параллельными плоскости основания призмы, а затем на плоскость основания проектируют линии пересечения — изотермы, указывая на каждой из них соответствующую ей температуру.

Рис. 50. Совокупность проекций нескольких сечений на плоскость составов; T1 > T2 > T3 > T4.
Понижение температуры в пределах концентрационного треугольника происходит от его вершин к центру.
Плоская диаграмма позволяет определять многие свойства системы с заданным сочетанием трех компонентов и изменение этих свойств при изменении исходного состава системы и температуры. С ее помощью можно определить, какова растворимость компонентов в жидком и твердом состояниях, образуются ли между ними химические соединения, меняются ли кристаллические модификации твердых фаз, как меняется состав и относительное количество фаз при изменении температуры, каков состав самой тугоплавкой или легкоплавкой системы, можно воссоздать вид кривой охлаждения системы заданного исходного состава и т. д.
4.2. Типовые диаграммы состояния трехкомпонентных конденсированных систем
Разумеется, многообразие сочетаний различных свойств в трехкомпонентных системах создает значительно большие трудности при построении и чтении диаграмм их состояния по сравнению с бинарными системами, поэтому здесь рассмотрены типовые диаграммы или диаграммы состояния простейших реальных систем.
4.2.1. Диаграмма состояния трехкомпонентной конденсированной системы без химических соединений и полиморфных превращений
Простейшая двухмерная диаграмма состояния трехкомпонентной конденсированной системы (рис. 51) на практике встречается крайне редко, но содержит основные элементы, входящие в состав диаграмм состояния более сложных систем.
На диаграмме существуют три поля, в которых происходит кристаллизация чистых компонентов диаграммы из равновесных жидких фаз. В каждом из полей диаграммы существуют по две фазы: кристаллический компонент и равновесная с ним жидкость. По мере понижения температуры, от вершин треугольника к центру, жидкая фаза теряет один из компонентов и обогащается двумя другими. В любом поле диаграммы число степеней свободы равно двум.
Области полей диаграммы ограничены линиями, называемыми граничными линиями, на которых происходит совместная кристаллизация двух компонентов соседних полей, т.е. на граничной линии в равновесии находятся три фазы и система обладает одной степенью свободы.
На сторонах треугольника показаны точки двойных эвтектик, в которых происходит совместная кристаллизация двух компонентов, по приведенным ниже уравнениям равновесий:
е1:
![]() ;
;
е2:
![]() ;
;
е3:
![]() .
.
В центре концентрационного треугольника
показана точка тройной эвтектики Е,
в которой происходит завершение процесса
кристаллизации по уравнению:
![]() .
Температура точки тройной эвтектики
является самой низкой в системе.
.
Температура точки тройной эвтектики
является самой низкой в системе.
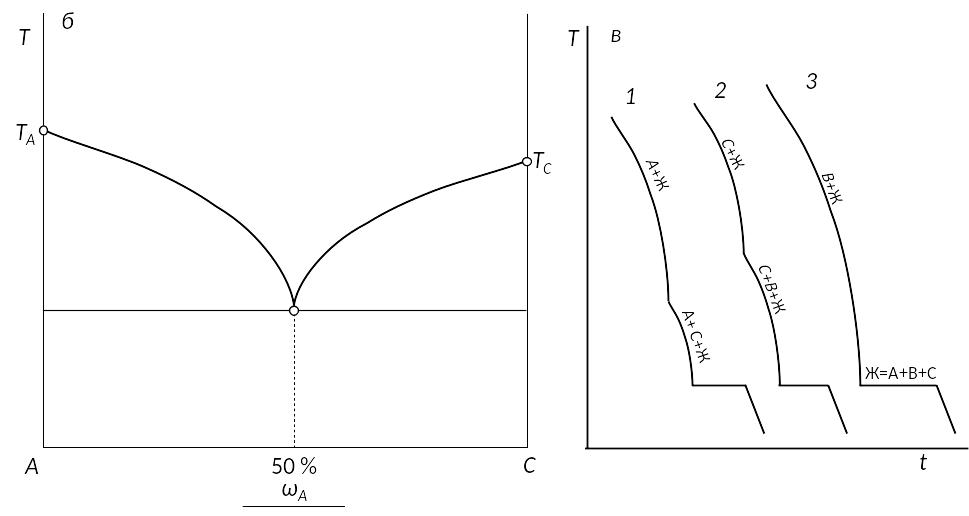
Проследить тенденцию изменения температуры в пределах диаграммы помогают так называемые «развертки диаграммы», представляющие собой вид сбоку на объемную диаграмму состояния. Для обсуждаемой диаграммы все развертки будут идентичны и представляют собой простейшую двухкомпонентную диаграмму состояния (рис. 51-б). Развертку можно строить непосредственно на стороне диаграммы, а можно оформить в виде отдельного рисунка.
Анализ хода изотерм диаграммы и разверток диаграммы дает возможность показать направления падения температуры по сторонам и граничным линиям диаграммы: от вершин треугольника к точкам двойных эвтектик и далее к точке тройной эвтектики (рис. 51-а).
Кристаллизация системы заданного состава (фигуративная точка 1 на диаграмме рис. 51-а) протекает по направляющей от «хозяина поля» в направлении общего снижения температуры: от точки по направляющей до граничной линии и по граничной линии по стрелке до точки тройной эвтектики.
Кристаллизация точки, расположенной на стороне треугольника (точка 2, рис. 51-а), протекает в направлении падения температуры к точке двойной эвтектики и, далее, к точке тройной эвтектики.
Кривые охлаждения, являющиеся экспериментальной основой получения диаграмм состояния, имеют те же тенденции, что и для двухкомпонентных систем: экзотермический эффект кристаллизации твердой фазы проявляется в виде выпуклой кривой. Точки двойных и тройных эвтектик сопровождаются температурной остановкой (рис. 51-в).

Рис. 51. Диаграмма состояния трехкомпонентной
конденсированной системы с одной
тройной точкой эвтектики (а), развертка
к ней (б) и кривые охлаждения (в).