
- •Конструкционные материалы теплоэнергетики
- •5В0717 - Теплоэнергетика
- •1 Лекция. Введение
- •Металлы
- •2 Лекция. Строение и свойства материалов
- •2.3 Кристаллографические направления и плоскости
- •2.4 Кристаллизации металлов
- •2.5 Превращения в твердом состоянии. Полиморфизм
- •3 Лекция. Конструкционные материалы и их механические свойства
- •3.1 Общие требования, предъявляемые к конструкционным материалам
- •3.2 Механические свойства металлов
- •3.2 Определение твердости металлов
- •4 Лекция. Основы теории сплавов
- •4.1 Основные понятия в теории сплавов
- •4.2 Особенности строения, кристаллизации и свойств сплавов: механических смесей, твердых растворов, химических соединений
- •4.3 Классификация сплавов твердых растворов
- •4.4 Диаграмма состояния
- •5 Лекция. Диаграммы состояния двухкомпонентных сплавов
- •5.1 Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов (I рода)
- •5.2 Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии (II рода)
- •5.3 Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии (ш рода)
- •5.4 Диаграмма состояния для сплавов, образующих химические соединения (IV рода)
- •5.5 Связь между свойствами сплавов к типом диаграммы состояния
- •6 Лекция. Железо и его сплавы
- •6.1 Диаграмма состояния железоуглеродистых сплавов
- •6.2. Углеродистые стали и влияние примесей на свойства сталей
- •6.3 Классификация сталей
- •6.4 Классификация чугунов
- •7 Лекция. Термическая обработка металлов
- •7.1 Виды термической обработки металлов
- •7.2.1 Первое основное превращение в стали (п → а) при нагреве
- •Продолжительность нагрева
- •8 Лекция. Выбор конструкционных материалов для теплоэнергетического оборудования с учетом эксплуатационных свойств.
- •8.1 Воздействие эксплуатационных нагрузок на стали для теплоэнергетического оборудования
- •8.2 Расчет на прочность поверхностей нагрева, нагруженных внутренних давлением
- •9 Лекция. Неметаллические конструкционные материалы
- •9.1 Общие характеристики неметаллических материалов
- •9.2 Силикатные материалы
- •9.3 Пластические массы
- •9.4 Резина
- •9.5. Конструкционные материалы на основе графита
- •9.6 Композиционные материалы
- •Список литературы
- •Содержание
2 Лекция. Строение и свойства материалов
Содержание лекции: Элементы кристаллографии. Особенности кристаллического строения вещества. Основные типы и параметры кристаллических решеток металлов. Механизм процесса кристаллизации и перекристаллизации. Полиморфные превращения. Для самостоятельного изучения: Реальное строение металлических кристаллов и их дефекты.
2.1 Элементы кристаллографии и особенности кристаллического строения вещества.
В твердых телах атомы могут размещаться в пространстве двумя способами:
- беспорядочное расположение атомов, когда они не занимают определенного места друг относительно друга. Такие тела называются аморфными.
Аморфные вещества обладают формальными признаками твердых тел, т.е. они способны сохранять постоянный объем и форму. Однако они не имеют определенной температуры плавления или кристаллизации.
- Упорядоченное расположение атомов, когда атомы занимают в пространстве вполне определенные места, такие вещества называются кристаллическими.
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком - периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
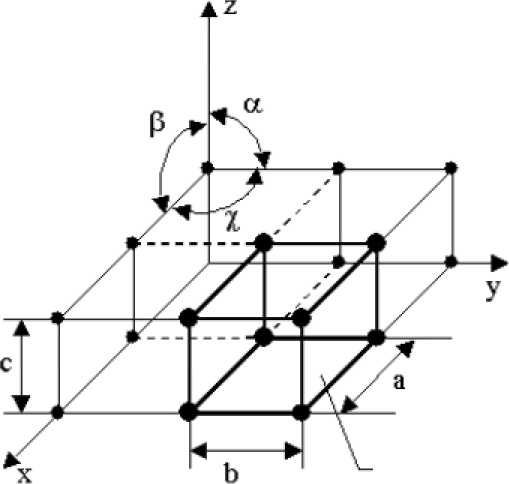
Элементарная
ячейка
Рисунок
2.1 Схема кристаллической решетки
2.1.1 Основные типы и параметры кристаллических решеток металлов
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа:
- примитивный - узлы решетки совпадают с вершинами элементарных ячеек;
- базоцентрированный - атомы занимают вершины ячеек и два места в противоположных гранях;
- объемно-центрированный - атомы занимают вершины ячеек и ее центр;
- гранецентрированный - атомы занимают вершины ячейки и центры всех шести граней
Основными типами кристаллических решеток металлов являются:
1.Объемно - центрированная кубическая (ОЦК) (смотри рисунок 2.2а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Fеα)
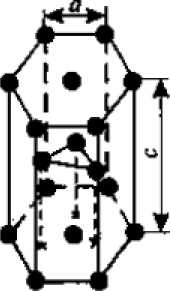
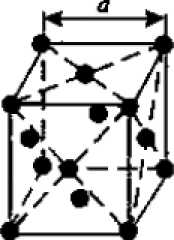
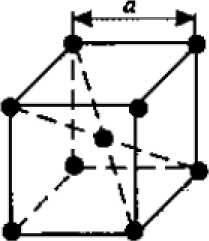
а) 6) в)
Рисунок 2.2 Основные типы кристаллических решеток металлов:
а - объемно-центрированная кубическая; б- гранецентрированная кубическая;
в - гексагональная плотноупакованная.
2.Гранецентрированная кубическая (ГЦК) (рисунок 2.2 б), атомы располагаются в вершинах куба и по центру каждой из 6 граней (Ag, Au, Fеγ)
3.Гексагональная, в основании которой лежит шестиугольник:
- простая - атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
- плотноупакованная (ГПУ) - имеется 3 дополнительных атома в средней плоскости (рисунок 2.2 в) (цинк).
Элементарная ячейка - элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл (рисунок 2.1).
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
- размеры ребер элементарной ячейки, а, b, с - периоды решетки - расстояния между центрами ближайших атомов. Период решетки - это расстояние между атомами по ребру элементарной ячейки, измеряется в нанометрах (1 нм = 10-9 м = 10 Ǻ.
Периоды кубических решеток характеризуются длиной ребра куба и обозначаются буквой а. Для характеристики гексагональной решетки принимают два параметра - сторону шестигранника а и высоту призмы с. Когда отношение с/а = 1,633, то атомы упакованы наиболее плотно, и решетка называется гексагональной плотноупакованной (рисунок 2.2 в),
- углы между осями (α, β, γ) (рисунок 2.1),
-координационное число определяет число ближайших равноудаленных элементарных частиц. Например, в решетке объемно-центрированного куба
(ОЦК) для каждого атома число таких соседей будет равно восьми (К 8). Для простой кубической решетки координационное число будет 6 (К 6). Для
гранецентрированной кубической решетки (ГЦК) координационное число равно 12 (К 12).
- базис решетки - количество атомов, приходящихся на одну элементарную ячейку решетки,
- плотность упаковки атомов в кристаллической решетке - объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки - 0,68, для гранецентрированной кубической решетки - 0,74)
