
- •Биологический факультет и факультет фундаментальной медицины мгу имени м.В. Ломоносова с.М.Струкова основы физиологии гемостаза
- •Глава 1 Структурно-функциональные особенности первичного гемостаза
- •Гемостаз – физиологическая реакция организма
- •Краткая история учения о гемостазе
- •Механизмы первичного тромбоцитарно-сосудистого гемостаза
- •Структура и функции тромбоцитов в первичном гемостазе.
- •Морфология тромбоцитов
- •Глава 2. Вторичный гемостаз
- •Факторы свертывания крови.
- •Cтруктурные особенности факторов свертывания крови.
- •Механизмы свертывания крови
- •Глава 3. Механизмы регуляции гемостаза.
- •Компоненты системы протеина с и механизм образования активного протеина с (арс)
- •Глава 4. Свертывание крови и воспаление
- •Список сокращений
- •Глава 1. Структурно-функциональные особенности первичного гемостаза
- •1.1. Гемостаз – физиологическая реакция организма.
- •1.2. Краткая история учения о гемостазе.
- •А.А.Шмидт (1863-1892) – создатель ферментативной теории свертывания крови.
- •Классическая ферментативная теория свертывания крови а.А. Шмидта
- •1.3. Механизмы первичного тромбоцитарно-сосудистого гемостаза
- •1.3.1. Основные этапы и фазы гемостаза.
- •Синтез эндотелием протромботических и антитромботических факторов
- •1.3.3.Фазы первичного тромбоцитарно-сосудистого гемостаза
- •1.3.4. Адгезия тромбоцитов к субэндотелию
- •1.3.4.1. Фактор фон Виллебранда: структура и свойства
- •Структура фактора фон Виллебранда: субъединицы и домены
- •Модель лиганд-рецепторного взаимодействия при повреждении эндотелия сосуда и экспонировании фактора фон Виллебранда
- •1.3.4.2. Гп Ib – рецептор фон Виллебранда фактора и тромбина
- •Структура комплекса гп Ib/IX/V и схема активации рецептора гп Ib фактором фон Виллебранда.
- •1.3.4.3. Активация тромбоцитов фактором фон Виллебранда
- •1.3.4.4. Интегрины – рецепторы адгезивных белков
- •1.4. Структура и функции тромбоцитов в первичном гемостазе.
- •1.4.1. Морфология тромбоцитов
- •Морфологические особенности тромбоцитов
- •1.4.2. Обратимая и необратимая агрегация тромбоцитов
- •1.4.2.1. Индукторы агрегации тромбоцитов
- •1.4.2. 2. Механизмы агрегации тромбоцитов
- •1.4.2.3. Активация тромбоцитов коллагеном
- •1.4.2.4. Активация тромбоцитов тромбином
- •1.4.2.5.Синтез и функции простагландинов в первичном гемостазе
- •1.4.2.5.Активация тромбоцитов адф
- •1.4.4.Ингибирование агрегации тромбоцитов
- •Глава 2. Вторичный гемостаз
- •2.1. Факторы свертывания крови.
- •Факторы свертывания крови и ингибиторы
- •2.2. Cтруктурные особенности факторов свертывания крови.
- •Доменная структура прокоагулянтных факторов и факторов контактной системы свертывания крови.
- •2.2.1. Факторы протромбинового комплекса
- •Структура витаминов к1(филлохинон), витамина к2 (менахинон) и антагонистов витаминов к – кумарина и варфарина.
- •2.2.2. Факторы контактной фазы свертывания
- •2.2.3. Кофакторы факторов свертывания
- •Домены кофакторов факторов свертывания крови- факторы V и VIII.
- •2.2.4. Субстрат свертывания - фибриноген
- •Структура молекулы фибриногена.
- •Механизм свертывания крови.
- •Активация и функции контактной фазы свертывания крови.
- •2.3.2. Внешний путь свертывания крови – основной механизм образования тромбина в кровотоке.
- •2.3.2.1. Тканевой фактор- инициатор активации свертывания крови
- •2.3.2.2. Образование сериновых протеаз гемостаза.
- •Упрощенная схема фаз инициации и распространения свертывания крови
- •2.3.2.3. Ингибирование активности факторов viIa и Xa ингибитором пути тканевого фактора tfpi
- •2.3.2.4. Особенности активации протромбина.
- •2.4. Функции протеиназ системы свертывания крови
- •2.4.1. Тромбин: структурно-функциональные особенности.
- •Изменение функций тромбина при связывании ионов Nа и аллостерическом изменении молекулы фермента
- •2.4.2 Превращение фибриногена в фибрин
- •2.4.3. Полифункциональность тромбина
- •Полифункциональность тромбина.
- •3.4. Рецепторы, активируемые протеиназами (par)
- •Характеристика рецепторов, активируемых протеиназами (par)
- •4. Контактная активация свертывания крови инициируется in vivo при воспалении, in vitro при контакте плазмы с отрицательно заряженной поверхностью.
- •Глава 3. Механизмы регуляции гемостаза
- •3.1. Основные механизмы обеспечения гемостатического баланса
- •3.2. Механизмы инактивации тромбина и других протеиназ гемостаза.
- •3.2.1. Инактивация протеиназ серпинами.
- •3.2.1.1. Инактивация тромбина антитромбином III
- •3.2.1.2. Инактивация тромбина кофактором II гепарина (hcii)
- •3.2.2. Инактивация факторов Xa и viIa ингибитором пути тканевого фактора (tfpi).
- •3.2.3. Инактивация фактора Xa серпином, зависимым от протеина z (zpi).
- •3.3. Антикоагулянтная система протеина с.
- •3.3.1.Ингибитор образования тромбина- протеин с
- •Структурные особенности протеина с
- •Конпоненты системы протеина с и механизм образования активного протеина с (арс)
- •Структура тромбомодулина (тм)
- •Свойства компонентов системы протеина с.
- •3.3.1.3.Функции активированного протеина с
- •Образование и свойства активированного протеина с(арс)
- •Фибринолитическая система
- •Основные компоненты системы фибринолиза
- •Основные компоненты системы фибринолиза
- •3.4.2.Особенности превращения плазминогена в плазмин
- •3.4.3.Основные стадии фибринолиза
- •Основные компоненты и стадии фибринолиза.
- •3.4.4.Различие функций тканевого активатора плазминогена (t-pa) и активатора плазминогена урокиназного типа (u-pa),
- •3.4.5. Протеолиз фибриногена и фибрина плазмином
- •Модель гидролиза фибриногена плазмином.
- •3.4.6. Ингибиторы фибринолиза
- •2) Блокирование образования тромбина системой протеина с;
- •3) Фибринолиз – лизис сгустка фибрина, регуляцию фибринолиза ингибиторами.
- •Глава 4. Свертывание крови и воспаление
- •4.1. Интеграция систем свертывания и воспаления
- •4.2. Механизмы индукции свертывания при воспалении
- •4.4. Роль тромбоцитов и моноцитов в сопряжении свертывания и воспаления
- •4.5. Участие нейтрофильных внеклеточных ловушек (neTs) в сопряжении воспаления и свертывания крови
- •4.6.Интеграция протеолитических систем крови при воспалении.
- •4.4.1. Участие антикоагулянтных и фибринолитической систем в регуляции воспаления
- •4.4.2. Разнонаправленное действие тромбина и активированного протеина с (арс) в реакциях свертывания и воспаления
- •2. Интеграция воспаления и свертывания осуществляется на всех этапах воспаления:
- •3. Ключевые протеиназы системы свертывания – тромбин и активированный протеин с, участвуют в активации или регуляции всех этапов воспаления.
Структура фактора фон Виллебранда: субъединицы и домены
Домены – функциональные единицы, устойчивые к протеолизу, соединяются участками, чувствительными к протеолизу. В молекуле фактора фон Виллебранда обнаружены домены, ответственные за связывание фактора VIII свертывания крови, рецепторов тромбоцитов - гликопротеиновых трансмембранных комплексов: ГП Ib/IX/V и интегрина aIIb/b3 (ГП IIb/IIIа), а также гепарина и коллагена.
Домены фон Виллебранда фактора состоят из пептидных блоков с гомологичной последовательностью. В N-концевых доменах D’ и D3 (1-272 а.о.) каждой субъединицы зрелого VWF обнаружены участки связывания и стабилизации фактора VIII, а так же места связывания гепарина и сульфатированных гликоаминогликанов и протеогликанов межклеточного матрикса. В домене А1 (449-728 а.о.) локализованы участки узнавания коллагена (типа IV), гепарина и рецептора ГП Ib/IX/V тромбоцитов. Участки дисульфидной петли домена А1 между Цис509 и Цис 695 играют ключевую роль в связывании фон Виллебранда фактора с ГП Ib еще не активированных тромбоцитов. Участки связывания VWF с ГП Ib формируются только после конформационных изменений в структуре А1 дисульфидной петли после иммобилизации фон Виллебранда фактора на коллагене субэндотелия. Нативная молекула растворимого VWF плазмы не способна связывать рецептор тромбоцитов ГП Ib.
В домене А1 по обе стороны от дисульфидной петли А1 локализованы участки связывания ристоцетина – антибиотика, который используют при изучении агрегации тромбоцитов. В домене А2 обнаружены участки связывания металлопротеиназы плазмы крови ADAMTS-13, которая расщепляет мультимеры фактора фон Виллебранда, а в домене А3 - центры связывания коллагенов ( типа I и III).
Последовательность типа С1 отвечает за связывание с интегрином aIIb/b3. В его структуре обнаружен реактивный участок молекулы – уникальный трипептид с последовательностью Арг1744-Гли1745-Асп1746 (RGD), который отвечает за связывание с интегринами клеток (рис. 1-4). Аналогичный пептид содержится в структуре многих адгезивных белков - фибриногена, фибронектина, тромбоспондина, витронектина и других (табл. 1-3).
На первой стадии адгезии (стадии контакта) происходит связывание фон Виллебранда фактора с ГП Ib комплекса ГП Ib/IX/V (рис. 1-5).
Существует прямая связь между размером фактора фон Виллебранда и его способностью вызывать образование тромбоцитарных тромбов. Структурно-функциональный анализ этого фактора у больных с болезнью Виллебранда выявил более высокую гемостатическую эффективность больших мультимеров.
Мультимеры очень высокого молекулярного веса, так называемые ультра-большие мультимеры, чрезвычайно тромбогенны вследствие повышенной способности связывать тромбоцитарный GPIb и вызывать образование циркулирующих агрегатов. Ультрабольшие мультимеры фактора фон Виллебранда быстро расщепляются металлопротеиназой плазмы крови ADAMTS-13(дезинтегрин и металлопротеиназа с тромбоспондиновым мотивом) до менее активных форм. ADAMTS-13 гидролизует одну пептидную связь (Tyr842-Met843) в домене А2 фактора фон Виллебранда, связанного с эндотелием. Нарушение необходимого протеолиза мультимеров фактор фон Виллебранда металлопротеиназой ADAMTS-13 на поверхности эндотелия в сосудах с высоким напряжением сдвига ведет к накоплению на эндотелии и в плазме не расщепленных или частично расщепленных мультимеров фактора фон Виллебранда и может вести к развитию системных тромботических микроангиопатий, таких как тромботическая тромбоцитопеническая пурпура (ТТП).
Рассмотрим подробнее реакции эндотелия на повреждение. Из телец Вейбеля-Палладе эндотелиальных клеток освобождается мультимер – фон Виллебранда фактор, который связывает коллагены субэндотелия и рецептор тромбоцитов - гликопротеин Iba (ГП Iba) и обеспечивает мобилизацию и активацию тромбоцитов (рис. 4,5). Фон Виллебранда фактор через два типа А доменов (А1 и А3) связывается с коллагенами субэндотелия, которые обнажаются при повреждении сосуда. А3 домен обеспечивает достаточно прочную иммобилизацию фон Виллебранда фактора на коллагенах типа I или типа III (субэндотелия), а домен А1 отвечает за связывание фактора с коллагеном типа VI. Кроме коллагенов другие компоненты субэндотелиального матрикса могут участвовать в связывании и иммобилизации фон Виллебранда фактора. Иммобилизованный на коллагене субэндотелия VWF через участок А1 домена взаимодействует с a-цепями ГП Ib и “привязывает” клетки, выполняя функции “мостика” между коллагеном и тромбоцитами (рис. 5).
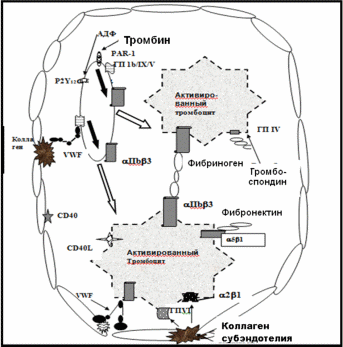
РИС. 1-5.
