
- •Биологический факультет и факультет фундаментальной медицины мгу имени м.В. Ломоносова с.М.Струкова основы физиологии гемостаза
- •Глава 1 Структурно-функциональные особенности первичного гемостаза
- •Гемостаз – физиологическая реакция организма
- •Краткая история учения о гемостазе
- •Механизмы первичного тромбоцитарно-сосудистого гемостаза
- •Структура и функции тромбоцитов в первичном гемостазе.
- •Морфология тромбоцитов
- •Глава 2. Вторичный гемостаз
- •Факторы свертывания крови.
- •Cтруктурные особенности факторов свертывания крови.
- •Механизмы свертывания крови
- •Глава 3. Механизмы регуляции гемостаза.
- •Компоненты системы протеина с и механизм образования активного протеина с (арс)
- •Глава 4. Свертывание крови и воспаление
- •Список сокращений
- •Глава 1. Структурно-функциональные особенности первичного гемостаза
- •1.1. Гемостаз – физиологическая реакция организма.
- •1.2. Краткая история учения о гемостазе.
- •А.А.Шмидт (1863-1892) – создатель ферментативной теории свертывания крови.
- •Классическая ферментативная теория свертывания крови а.А. Шмидта
- •1.3. Механизмы первичного тромбоцитарно-сосудистого гемостаза
- •1.3.1. Основные этапы и фазы гемостаза.
- •Синтез эндотелием протромботических и антитромботических факторов
- •1.3.3.Фазы первичного тромбоцитарно-сосудистого гемостаза
- •1.3.4. Адгезия тромбоцитов к субэндотелию
- •1.3.4.1. Фактор фон Виллебранда: структура и свойства
- •Структура фактора фон Виллебранда: субъединицы и домены
- •Модель лиганд-рецепторного взаимодействия при повреждении эндотелия сосуда и экспонировании фактора фон Виллебранда
- •1.3.4.2. Гп Ib – рецептор фон Виллебранда фактора и тромбина
- •Структура комплекса гп Ib/IX/V и схема активации рецептора гп Ib фактором фон Виллебранда.
- •1.3.4.3. Активация тромбоцитов фактором фон Виллебранда
- •1.3.4.4. Интегрины – рецепторы адгезивных белков
- •1.4. Структура и функции тромбоцитов в первичном гемостазе.
- •1.4.1. Морфология тромбоцитов
- •Морфологические особенности тромбоцитов
- •1.4.2. Обратимая и необратимая агрегация тромбоцитов
- •1.4.2.1. Индукторы агрегации тромбоцитов
- •1.4.2. 2. Механизмы агрегации тромбоцитов
- •1.4.2.3. Активация тромбоцитов коллагеном
- •1.4.2.4. Активация тромбоцитов тромбином
- •1.4.2.5.Синтез и функции простагландинов в первичном гемостазе
- •1.4.2.5.Активация тромбоцитов адф
- •1.4.4.Ингибирование агрегации тромбоцитов
- •Глава 2. Вторичный гемостаз
- •2.1. Факторы свертывания крови.
- •Факторы свертывания крови и ингибиторы
- •2.2. Cтруктурные особенности факторов свертывания крови.
- •Доменная структура прокоагулянтных факторов и факторов контактной системы свертывания крови.
- •2.2.1. Факторы протромбинового комплекса
- •Структура витаминов к1(филлохинон), витамина к2 (менахинон) и антагонистов витаминов к – кумарина и варфарина.
- •2.2.2. Факторы контактной фазы свертывания
- •2.2.3. Кофакторы факторов свертывания
- •Домены кофакторов факторов свертывания крови- факторы V и VIII.
- •2.2.4. Субстрат свертывания - фибриноген
- •Структура молекулы фибриногена.
- •Механизм свертывания крови.
- •Активация и функции контактной фазы свертывания крови.
- •2.3.2. Внешний путь свертывания крови – основной механизм образования тромбина в кровотоке.
- •2.3.2.1. Тканевой фактор- инициатор активации свертывания крови
- •2.3.2.2. Образование сериновых протеаз гемостаза.
- •Упрощенная схема фаз инициации и распространения свертывания крови
- •2.3.2.3. Ингибирование активности факторов viIa и Xa ингибитором пути тканевого фактора tfpi
- •2.3.2.4. Особенности активации протромбина.
- •2.4. Функции протеиназ системы свертывания крови
- •2.4.1. Тромбин: структурно-функциональные особенности.
- •Изменение функций тромбина при связывании ионов Nа и аллостерическом изменении молекулы фермента
- •2.4.2 Превращение фибриногена в фибрин
- •2.4.3. Полифункциональность тромбина
- •Полифункциональность тромбина.
- •3.4. Рецепторы, активируемые протеиназами (par)
- •Характеристика рецепторов, активируемых протеиназами (par)
- •4. Контактная активация свертывания крови инициируется in vivo при воспалении, in vitro при контакте плазмы с отрицательно заряженной поверхностью.
- •Глава 3. Механизмы регуляции гемостаза
- •3.1. Основные механизмы обеспечения гемостатического баланса
- •3.2. Механизмы инактивации тромбина и других протеиназ гемостаза.
- •3.2.1. Инактивация протеиназ серпинами.
- •3.2.1.1. Инактивация тромбина антитромбином III
- •3.2.1.2. Инактивация тромбина кофактором II гепарина (hcii)
- •3.2.2. Инактивация факторов Xa и viIa ингибитором пути тканевого фактора (tfpi).
- •3.2.3. Инактивация фактора Xa серпином, зависимым от протеина z (zpi).
- •3.3. Антикоагулянтная система протеина с.
- •3.3.1.Ингибитор образования тромбина- протеин с
- •Структурные особенности протеина с
- •Конпоненты системы протеина с и механизм образования активного протеина с (арс)
- •Структура тромбомодулина (тм)
- •Свойства компонентов системы протеина с.
- •3.3.1.3.Функции активированного протеина с
- •Образование и свойства активированного протеина с(арс)
- •Фибринолитическая система
- •Основные компоненты системы фибринолиза
- •Основные компоненты системы фибринолиза
- •3.4.2.Особенности превращения плазминогена в плазмин
- •3.4.3.Основные стадии фибринолиза
- •Основные компоненты и стадии фибринолиза.
- •3.4.4.Различие функций тканевого активатора плазминогена (t-pa) и активатора плазминогена урокиназного типа (u-pa),
- •3.4.5. Протеолиз фибриногена и фибрина плазмином
- •Модель гидролиза фибриногена плазмином.
- •3.4.6. Ингибиторы фибринолиза
- •2) Блокирование образования тромбина системой протеина с;
- •3) Фибринолиз – лизис сгустка фибрина, регуляцию фибринолиза ингибиторами.
- •Глава 4. Свертывание крови и воспаление
- •4.1. Интеграция систем свертывания и воспаления
- •4.2. Механизмы индукции свертывания при воспалении
- •4.4. Роль тромбоцитов и моноцитов в сопряжении свертывания и воспаления
- •4.5. Участие нейтрофильных внеклеточных ловушек (neTs) в сопряжении воспаления и свертывания крови
- •4.6.Интеграция протеолитических систем крови при воспалении.
- •4.4.1. Участие антикоагулянтных и фибринолитической систем в регуляции воспаления
- •4.4.2. Разнонаправленное действие тромбина и активированного протеина с (арс) в реакциях свертывания и воспаления
- •2. Интеграция воспаления и свертывания осуществляется на всех этапах воспаления:
- •3. Ключевые протеиназы системы свертывания – тромбин и активированный протеин с, участвуют в активации или регуляции всех этапов воспаления.
Домены кофакторов факторов свертывания крови- факторы V и VIII.
Стрелками указаны связи, расщепляемые тромбином при активации факторов V и VIII.
Фактор VIII секретируется как гетеродимер вследствие расщепления по крайней мере двух связей в В домене. В циркуляции белок стабилизирован фон Виллебранда фактором и имеет время полужизни около 10 часов. Тромбин гидролизует фактор VIII по остаткам Arg372, Arg740 и Arg1689, выщепляя В домен и расщепляя один из высокоаффинных участков связывания фон Виллебранда фактора (рис.2-17). Фактор VIII превращается в фактор VIIIа, гетеротример (А1/А2/А3-С1-С2), субъединицы которого стабилизированы ионами Са. Фактор VIIIа – эффективный кофактор фактора IXa, активатора фактора X. Инактивация фактор VIIIа происходит вследствие диссоциации двух А доменов тяжелой цепи или специфического расщепления связи между А1 и А2 доменами активированным протеином С. Фон Виллебранда фактор повышает стабильность фактора VIII и защищает его от инактивации АРС. Контроль активации фактора X является критическим событием гемостаза и тромбоза.
2.2.4. Субстрат свертывания - фибриноген
Фибриноген, составляющий структурную основу тромба, состоит из трех пар не идентичных полипептидных цепей, обозначаемых как Аaa, Вbb и gg (рис. 2-18).
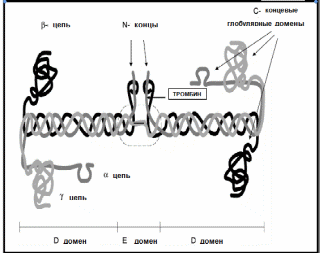
Рис 2-18
Структура молекулы фибриногена.
Молекула фибриногена состоит из трех пар полипептидных цепей-А альфа,В бета,гамма, об`единенных в три домена DED.
Молекула фибриногена состоит из трех модулей (доменов), выявленных электронной микроскопией. Аминоконцевые части всех трех цепей образуют центральную область взаимодействия двух субъединиц молекулы фибриногена, ковалентно связанных между собой тремя дисульфидными мостиками, так называемый, Е домен. Карбокси(С)концевые участки bb и gg цепей образуют D домены фибриногена.
Фактор XIII - фибринстабилизирующий фактор, существует в двух формах –плазменный и тромбоцитарный. Плазменный фактор XIII- тетрамер , состоящий из двух пар цепей ( и ), а тромбоцитарный содержит только - цепи.
Механизм свертывания крови.
Разделение механизма свертывания крови на два пути – внутренний (контактная фаза свертывания) и внешний существовало по крайней мере три десятилетия от начала 60-х годов XX века, когда был предложен каскадный механизм реакций образования тромбина.
2.3.1. Контактная фаза свертывания крови.
Контактная активация свертывания крови инициируется in vivo при воспалении, in vitro при контакте плазмы с отрицательно заряженной поверхностью.
На отрицательно заряженной поверхности происходит сборка ассамблеи факторов XII, XI и прекалликреина вместе с кофактором фактора XI и рецептором прекалликреина -высокомолекулярным кининогеном (рис. 2-19).
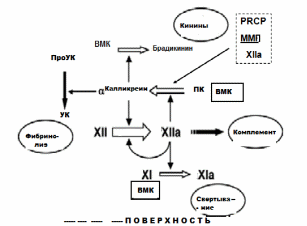
Рис. 2-19
Активация и функции контактной фазы свертывания крови.
Фактор XII превращается в протеиназу- фактор XIIa под действием протеиназы – калликреина. Активаторы превращения прекалликреина (ПК) плазмы в калликреин: фактор XIIa, матриксные металлопротеиназы (ММП) и пролилкарбоксипептидаза (PRCP). Калликреин расщепляет фактор XII до фактор XIIa в реакции положительной обратной связи. Фактор XIIa превращает фактор XI в XIa. Калликреин отщепляет от молекулы высокомолекулярного кининогена (ВМК)( кофактора ПК и фактора XI) пептид –брадикинин. Калликреин активирует превращение проурокиназы (проУК) в урокиназу(УК,uPA).
Связывание фактора XII с отрицательно заряженной поверхностью изменяет конформацию молекулы и делает ее более чувствительной к активации. Фактор XII превращается в активную сериновую протеиназу, фактор XIIa, аутокаталитически или под действием другой протеиназы – калликреина. Активаторами превращения прекалликреина плазмы в калликреин могут служить ряд протеиназ: фактор XIIa ( реципроктная активация), матриксные металлопротеиназы (ММП, MMP), которые появляются в участке повреждения сосуда и воспаления из предшественников - ПроММП, а также пролилкарбоксипептидаза(PRCP), фермент инактивирующий ангиотензин II и обеспечивающий взаимодействие калликреиновой и ренин-ангиотензиновой систем. Появившийся калликреин быстро расщепляет неактивный фактор XII в фактор XIIa в реакции положительной обратной связи, которая кинетически более эффективна, чем аутоактивация фактора XII. Калликреин расщепляет высокомолекулярный кининоген (ВМК), освобождая вазоактивный пептид- брадикинин (Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg), сильный вазодилататор, который повышает сосудистую проницаемость, стимулирует ноцицептивные рецепторы и вызывает сокращение ряда гладких мышц (например, подвздошной кишки). Калликреин стимулирует превращение проурокиназы (проУК) в урокиназу(УК).
Структурные особенности фактора XII (см.выше) свидетельствуют о его многофункциональности. Основная функция фактора XII -активация фактора XI. Фактор XI состоит из двух идентичных цепей с высокой степенью гомологии прекалликреину. Подобно прекалликреину он существует в кровотоке в комплексе с ВМК. ВМК обеспечивает связывание фактора XI c отрицательно заряженной поверхностью и способствует его активации протеиназами, фактором XIIа, XIа и тромбином, каждый их которых расщепляет в мономерах фактора XI пептидную связь Arg369-Ile370.
Фактор XI активирует фактор IX в IXa. На уровне IX фактора объединяются внутренний и внешний пути свертывания. Физиологическое значение внутненнего пути не ясно, хотя участие контактной фазы в процессах воспаления не вызывает сомнений. Показано,что недостаточность фактора XII не ведет к кровоточивости,напротив обнаружена склонность к тромбообразованию. Приобретенная недостаточность факторов контактной фазы выявлена у пациентов с новообразованиями, сепсисом, аллергическими реакциями. Пептид, брадикинин, освобождаемый из ВМК калликреином, является модулятором тонуса сосудов. Образование фактора IXa -общая стадия внутреннего и внешнего пути, согласно устаревшему представлению о механизме свертывания крови в нормальном физиологическом процессе гемостаза.
