
- •26. Способы определения тромбоцитов, сравн. Хар-ка.
- •27. Автоматические методы анализа клеток крови. Принципы работы, преимущества и недостатки.
- •По числу определяемых показателей все гематологические анализаторы делятся на четыре группы.
- •Принципы работы гематологических анализаторов
- •29. Тромбоцитопении, классификация. Лаборат. Показатели крови при аутоиммунной тромбоцитопенической пурпуре.
- •1. Тромбоцитопении, связанные со снижением образования тромбоцитов (недостаточность кроветворения).
- •31. Алгоритм диагностики анемического синдрома. Дифференциальная диагностика железоненасыщенных и железонасыщенных анемий.
- •32. Изменения общего анализа крови, картины костного мозга при сидероахрестической анемии.
По числу определяемых показателей все гематологические анализаторы делятся на четыре группы.
ГРУППА |
ОСНОВНЫЕ ПОКАЗАТЕЛИ |
ДОПОЛ. ПОКАЗАТЕЛИ |
I 8 - 9 показателей, 3 гистограммы |
Эритроциты (RBC), лейкоциты (WBC), тромбоциты (Plt), гемоглобин (Hb), гематокрит (Htc), средний объем эритроцитов (MCV), среднее содержание гемоглобина в эритроцитах (MCH), средняя концентрация гемоглобина в эритроцитах (MCHC), гистограммы: эритроциты, лейкоциты, тромбоциты. |
Тромбокрит (Pct). |
II 16 - 20 показателей, 3 гистограммы |
Показатели I группы плюс: коэффициент вариации объема эритроцитов (RDW), лимфоциты (Lmabs./ Lm%), гранулоциты (Grabs./ Gr%), средняя фракция лейкоцитов (Midabs./ Mid%), тромбокрит (Pct), средний объем тромбоцитов (MPV). |
Анизоцитоз тромбоцитов(PDW), крупные тромбоциты (LPCR), С-реактивный белок. |
III 24-28 показателей, 3 гистограммы, 3 скетограммы |
Показатели I группы плюс: коэффициент вариации объема эритроцитов (RDW), крупные тромбоциты (LPCR), анизоцитоз тромбоцитов(PDW), дифференцировка лейкоцитов на 5 популяций: базофилы (BAabs/%), эозинофилы (EOabs/%), нейтрофилы (NEabs/%), лимфоциты (LYabs/%), моноциты (MOabs/%), атипичные лимфоциты (ALY), большие незрелые клетки (LIC). |
Ретикулоциты (RETabs/%). |
IV до 40 показателей, 3 гистограммы, несколько скетограмм |
Показатели III группы плюс: ретикулоциты с низким содержанием РНК (RETL), ретикулоциты со средним содержанием РНК (RETM), ретикулоциты с высоким содержанием РНК (RETH), индекс зрелости ретикулоцитов (IRF), незрелые гранулоциты (IMMabs/%). |
Полностью автоматическая система подготовки мазков крови с возможностью осуществления окраски по нескольким методикам. |
Принципы работы гематологических анализаторов
Наибольшее распространение получили приборы, подсчет клеток в которых основан на кондуктометрическом способе, который получил также название метода Култера. На более сложных приборах применяются оптические и радиочастотные детекторы.
Кондуктометрические приборы считают клетки путем пропускания их суспензии через отверстие малого диаметра (апертуру) и определения значений электрического сопротивления, вызванных прохождением клеток. Пропуская через апертуру строго определенное количество суспензии и регистрируя число импульсов, осуществляется подсчет клеток, а анализ амплитуды импульсов позволяет оценить размеры микрообъектов.
Кондуктометрический тип счетчиков приспособлен для точного подсчета эритроцитов, лейкоцитов и тромбоцитов. Для подсчета эритроцитов пробу крови разбавляют в изотоническом растворе. Поскольку в норме число эритроцитов значительно превышает количество лейкоцитов, наличие последних в растворе обычно не влияет на результат исследования.
Для подсчета лейкоцитов необходимо лизировать эритроциты. Слишком высокое содержание клеток в растворе может привести к тому, что две частицы или более будут проходить через апертуру одновременно. Этот источник ошибок может быть корректирован использованием большого количества растворителя на одну пробу или электронным путем.
Подсчет тромбоцитов проводят после седиментации эритроцитов или, на более новых моделях приборов, одновременно с подсчетом эритроцитов.
Кондуктометрические счетчики обладают возможностями не только подсчитывать клетки, но также измерять их объем. Зная средний объем эритроцита и содержание этих клеток в крови, легко вычислить гематокрит. На таких приборах можно определять до 18 параметров крови:
Параметр |
Пределы измерения |
|
||
HGB |
Концентрация гемоглобина |
Ж: 140 ± 20 г/л |
|
|
М: 160 ± 20 г/л |
|
|
||
RBC |
Количество эритроцитов |
Ж: 4,8 ± 0,6 х 1012/л |
|
|
М: 5,4 ± 0,8х1012/л |
|
|
||
HCT |
Гематокрит |
Ж: 42 ± 5% |
|
|
М: 47 ± 5% |
|
|
||
MCV |
Средний объем эритроцита |
87 ± 5 фл |
|
|
МСН |
Среднее содержание НЬ в эритроците |
29 ± 2 пг |
|
|
МСНС |
Средняя концентрация НЬ в эритроците |
34 ± 2 г/дл |
|
|
RDW |
Коэффициент анизотропии эритроцита |
11,5—14,5% |
|
|
WBC |
Количество лейкоцитов |
4,0-9,0 х 109/л |
|
|
GRAN |
Количество гранулоцитов |
|||
NEYT |
Количество нейтрофилов |
48-78% |
|
|
2,04 5,8 х 109/л |
|
|
||
ЕО |
Количество эозинофилов |
0,5—5% |
|
|
0,02—0,30 х 109/л |
|
|
||
BASO |
Количество базофилов |
0-1% |
|
|
0—0,065 х 109/л |
|
|
||
MONO |
Количество моноцитов |
3-11% |
|
|
0,09-0,60 х 109/л |
|
|
||
LYMPH |
Количество лимфоцитов |
19—37% |
|
|
1,20-3,00 х 109/л |
|
|
||
PLT |
Количество тромбоцитов |
180,0-320,0 х 109/л |
|
|
PDW |
Коэффициент анизотропии тромбоцитов |
11,5-15,5% |
|
|
MPV |
Средний объем тромбоцитов |
8-12 фл |
|
|
PCT |
Тромбокрит |
- |
|
|
Гистограммы (распределение клеток по объему)
- Эритроцитарная
- Тромбоцитарная
- Лейкоцитарная.
Кроме того, прибор, регистрирующий 3 гистограммы распределения клеток по объему (эритроциты, лейкоциты, тромбоциты). С появлением анализаторов крови, регистрирующих множество параметров, интерпритация результатов анализа крови претерпела некоторые изменения. Некоторые из новых параметров, хотя и были приняты и исполняются на практике, до сих пор не имеют надежной шкалы показателей нормы.
Высокотехнологические гематологические анализаторы способны осуществлять дифференцированный счет лейкоцитов по 5-ти (5Diff) основным популяциям, используя различные принципы дифференцирования клеток: нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты, оценивать наличие незрелых гранулоцитов, анализировать ретикулоциты и их субпопуляции, проводить оценку стволовых гемопоэтических клеток и субпопуляций лимфоцитов. Многочисленные функции современных гематологических анализаторов стали возможны, благодаря развитию новых технологий, которые отличаются у разных фирм-производителей.
Так, в анализаторах фирмы Bekman-Coulter (LH 500, LH750) (США - Франция) используется трехмерный анализ дифференцировки лейкоцитов (VCS-технология), который включает в себя одновременный компьютерный анализ клеток по объему (Volume), электропроводности (Conductivity) и дисперсии лазерного света (Scatter).
Принцип проточной цитометрии. Клеточная суспензия попадает в поток жидкости, проходящий через проточную ячейку. Условия подобраны таким образом, что клетки выстраиваются друг за другом за счет так называемого гидродинамического фокусирования струи в струе. В момент пересечения клеткой лазерного луча детекторы фиксируют рассеяние света под малыми углами (от 1° до 10°) и рассеяние света под углом 90° клеток.
Далее, состав и характеристики крови определяют по трём параметрам: электрическому сопротивлению, ёмкости и светорассеянию. Эти характеристики определяются следующими методами:
А) V=Volume. Метод, лежащий в основе подсчета клеток и определения их объема (принцип Культера), основан на изменении сопротивления в электрической цепи при прохождении подсчитываемых частиц через микроотверстие. Амплитуды образующихся при этом импульсов пропорциональны размерам клеток, а их количество — числу клеток.
Б) C=Conductivity. Емкостные характеристики клеток, дают информацию об их внутренней структуре, в том числе плотность и размеры ядра, а также позволяют определить электрическую непрозрачность клетки и оценить сигнал проводимости. Используются для определения размера ядра, его плотности, соотношения ядро/цитоплазма, а также для выявления клеток одного размера, но разной внутренней структуры.
В) S=Scatter. Характеристики светорассеяния позволяет оценить рассеяние лазерного излучения неокрашенными клетками, получить информацию о гранулярности и структуре поверхности клеток, сегментированности ядер, а также позволяет классифицировать субпопуляций лейкоцитов и ретикулоцитов.
Г) Принцип “VCS”. Уникальное сочетание трёх способов измерения позволяет быстро, с высокой чувствительностью и достоверностью проводить гематологические исследования, включая дифференцировку популяций лейкоцитов и оценку ретикулоцитов.
Полученные по трем каналам данные с помощью электроники комбинируются и анализируются, в результате чего происходит распределение клеток по дифференцировочным кластерам и, таким образом, лейкоциты разделяются на пять основных популяций: лимфоциты, моноциты, нейтрофилы, эозинофилы и базофилы. Результатом отображения объемного графика на плоскости является лейкоцитарная скатерограмма, на которой каждый тип клеток имеет свою зону расположения.
В современных приборах часто используются дополнительные приёмы для повышения точности исследований; такие как IntelliKinetics — процесс подготовки образца, осуществляемый в приборе, автоматически корректируется в зависимости от условий окружающей среды (изменение времени инкубации, объема лизирующих реагентов т.д.).
AccuGate — программное обеспечение, позволяющее с высокой точностью и достоверностью оценивать изменения параметров клеток (объема, электрической проводимости и непрозрачности, светорассеяния).
В анализаторах серии Cell-Dyn для дифференцировки лейкоцитов применяется технология MAPSS - Multi Angle Polarized Scatter Separation - мультипараметрическая система лазерного светорассеивания - регистрация интенсивности рассеивания клетками поляризованного лазерного луча под разными углами. Этот метод заключается в компьютерном анализе дисперсии лазерного счета клетками крови. Рассеивание клеткой поляризованного лазерного луча под разными углами дает сведения о таких ее свойствах, как:
- размер клеток - для чего оценивается прохождение поляризованного лазерного луча под малым углом рассеивания (близким к 0 град.);
- структура и степень сложности клеток - оценивается по анализу рассеивания поляризованных лазерных лучей, направленных под углом до 7 град.;
- ядерно-цитоплазматическое соотношение - оценивается по анализу рассеивания поляризованных лазерных лучей, направленных под углом до 10 град.;
- оценка формы клеточного ядра - осуществляется благодаря анализу светорассеивания поляризованных лазерных лучей под углом 90 град.;
- для оценки клеточной зернистости и дифференцировки эозинофилов используется оценка светорассеивания деполяризованного луча под углом в 90 град.
В приборах серии Technicon, ADVIA120, 2120, Pentra DX 120 разработан принцип жидкостной цитохимии (измерение активности пероксидазы в лейкоцитах), который в сочетании с другими методами (кондуктометрический, гидродинамическое фокусирование, оптическая абсорбция) позволяет проводить дифференцировку лейкоцитов.
Использование пероксидазной реакции основано на различной ее активности в лейкоцитах. Так, эозинофилы и нейтрофилы имеют интенсивную пероксидазную активность, моноциты - слабую, в лимфоцитах она не выявляется.
Проточная цитохимическая техника включает регистрацию рассеянного и поглощенного светового луча. В лейкоцитарном канале после лизиса эритроцитов и стабилизации лейкоцитов происходит цитохимическая реакция, далее лейкоциты дифференцируются по двум признакам: размеру клеток, определяемому методом рассеивания лазерного луча, и пероксидазной активности - по поглощению клеткой светового потока. Дифференцировка базофилов от других гранулоцитов проводится в базоканале. Цитоплазма всех лейкоцитов за исключением базофилов подвергается лизису после обработки пробы специфическим лизатом. Затем в канале осуществляется измерение дисперсии лазерного света под углами 2 град. - 3 град. и 5 град. - 15 град., что позволяет различить клетки в зависимости от формы ядер.
Сравнивая информацию, получаемую с Perox- и Baso-каналов, компьютер осуществляет дифференцировку лейкоцитов на 5 основных популяций, а также сигнализирует в виде флагов о присутствии в крови активированных лимфоцитов, незрелых гранулоцитов, бластов, эритробластов.
В гематологических анализаторах серии XT и ХЕ фирмы Sysmex применяется метод проточной цитофлюориметрии с использованием флюоресцентного красителя полиметина. Этот флюоресцентный краситель связывается с ДНК и РНК неизмененных клеток, что позволяет использовать его как для дифференцировки лейкоцитов по 5-ти параметрам (нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты), так и для подсчета ретикулоцитов. Анализ клеток происходит в проточной кювете при пересечении луча лазера длиной 633 нм. После контакта лазерного луча с окрашенной клеткой происходит рассеивание последнего под большим и малым углами и возбуждение флюоресцентного красителя. Данные сигналы улавливаются фотоумножителями и регистрируются в виде трех параметров:
1. Светорассеивание под малым углом (FSC) - отклонение лазерного луча под малым (до 10 град.) углом, которое зависит от размера (объема, только при условии сферической формы частицы) и формы клетки;
2. Боковое светорассеивание (SSC) - рассеивание под углом до 90 град. зависит от рефрактерного индекса (или плотности) клетки и характеризует сложность внутриклеточных структур;
3. Детекция специфического флюоресцентного сигнала (SFL), которая регистрируется также как боковое светорассеивание под углом 90 град. и позволяет судить о содержании РНК/ДНК в клетках.
На основании полученных сигналов все клетки распределяются по соответствующим кластерам (зонам) в соответствии с их размером, структурой и количеством ДНК. Таким образом, происходит дифференцировка лейкоцитов на 4 популяции: лимфоциты, моноциты, эозинофилы и нейтрофилы вместе с базофилами. Разделение нейтрофилов и базофилов происходит в базоканале, где используется метод специфического химического лизиса, основанный на предварительной обработке лейкоцитов реактивом, осуществляющим лизис всех клеток, за исключением базофилов, с последующим дискриминантным анализом всех элементов по размеру и сложности структуры и количеству ДНК.
Кроме того, приборы оборудованы каналом для выделения незрелых гранулоцитов и атипичных лимфоцитов.
Таким образом, использование приборов с полным дифференцированным подсчетом лейкоцитов (5Diff) позволяет повысить точность дифференциального подсчета лейкоцитов, провести скрининг нормы и патологии, динамический контроль за лейкоцитарной формулой и резко сократить ручной подсчет лейкоцитарной формулы, оставляя примерно до 15-20% образцов крови для световой микроскопии.
Определение гемоглобина
В классическом гемиглобинцианидном методе (метод Драбкина) Fe+2 гемоглобина окисляется до Fe+3 метгемоглобина феррицианидом, затем метгемоглобин переводится в стабильный цианметгемоглобин цианидом. Оптическая плотность CNmetHb измеряется при 540 нм, при которой имеется максимум поглощения. Гемиглобинцианидный метод рекомендован Международным комитетом по стандартизации в гематологии Всемирной Организации Здравоохранения и используется в мировой практике более 30 лет.
В гематологических анализаторах к методам определения гемоглобина предъявляется ряд специфических требований. Во-первых, время реакции должно быть в десятки раз меньше для обеспечения высокой производительности анализаторов. Во-вторых, для оптимизации конструкции анализаторов гемоглобин должен измеряться в том же гемолизате, который используется для подсчета лейкоцитов, и, следовательно, компоненты, обеспечивающие гемоглобиновую реакцию, не должны негативно влиять на подсчет лейкоцитов.
Многие гематологические анализаторы измеряют концентрацию гемоглобина модифицированным гемиглобинцианидным методом. Высокая скорость реакции достигается путем быстрого лизиса эритроцитов, денатурирования и окисления гемоглобина до Fe+3 с помощью поверхностно-активных веществ. Последующая реакция с цианидом формирует устойчивую форму со спектром поглощения, похожим на спектр гемиглобинцианида в методе Драбкина, и максимумом поглощения около 545 нм. Достоинством метода является его простота, высокая скорость реакции и стабильность конечного продукта. Применение циановых методов в гематологических автоанализаторах имеет два существенных недостатка, связанных с тем, что цианид из флаконов постепенно выпаривается в виде синильной кислоты. Во-первых, это может оказывать вредное воздействие на персонал при плохой вентиляции помещения. Во-вторых, это приводит к ухудшению реакции и изменению калибровки по гемоглобину через 2 - 3 месяца после подсоединения к прибору флакона с гемолитиком.
Учитывая недостатки модифицированных гемиглобинцианидных методов, в последние годы в большинстве новых моделей гематологических анализаторов используются бесциановые методы. Одной из первых бесциановый SLS (натрий лаурил сульфат)-метод использовала фирма Sysmex. Этот метод оказался не совместимым с определением лейкоцитов в одном канале, для его реализации используется дополнительный реагент и канал измерения.
В других современных бесциановых методах используются компоненты гемихромной реакции, которые совместимы с подсчетом лейкоцитов и их дифференциацией на три популяции. Высокая скорость реакции достигается путем быстрого лизиса эритроцитов, денатурирования и окисления гемоглобина до Fe+3 с помощью окислителей в присутствии поверхностно-активных веществ. При этом в качестве лигандов атомов железа гема используются отличные от цианида вещества.
Оптимальной областью фотометрирования является максимум спектральной кривой поглощения. Для гемиглобинцианида - это 540 нм (рис. 27 - не приводится), которая и есть рабочая длина волны для этого метода. Измерение в максимуме кривой, где смягчаются требования к точности установки длины волны, снижает требования к точности изготовления и стабильности оптических фильтров. Максимум кривой поглощения гемихрома находится на длине волны 533 нм. Однако измерение на этой длине волны возможно только в спектрофотометрах. В фотометрических ячейках гематологических анализаторов, как правило, применяются полосовые светофильтры с типовыми длинами волн. Ближайшая к 533 нм типовая длина волны 540 нм, на которой и проводится фотометрирование с учетом коэффициента пересчета для 540 нм. При переходе с цианового на бесциановый метод, как правило, требуется корректировка калибровки гемоглобина в пределах 0 - 5%.
Качество результатов исследования крови на гематологическом анализаторе определяется следующими факторами:
- точностью дозирования цельной или разведенной крови;
- точностью дозирования изотонического раствора при проведении процедуры разведения крови;
- точностью определения объема суспензии, пропущенного через датчики подсчета клеток;
- точностью самого подсчета клеток;
- точностью определения размеров клеток;
- корректностью математических методов обработки первичных результатов измерений.
Во избежание случаев несовместимости реагентов следует использовать изотонический раствор и гемолитик от одного изготовителя. При смене реагентов одного производителя на реагенты другого производителя необходимо проверить калибровку анализатора по контрольной крови, обращая особое внимание на Hb и MCV/HCT, и при необходимости нужно делать перекалибровку этих показателей. Калибровка других показателей, как правило, не меняется.
При эксплуатации гематологических анализаторов важную роль играет качество электрической сети и заземления. Внезапное отключение электропитания приводит к сбоям в работе приборов и необходимости вмешательства инженеров сервисной службы. В том случае, если электрическое питание пропадает в момент забора пробы или анализа и появляется спустя несколько часов (5 - 20 ч), последствия могут оказаться значительно более серьезными - может выйти из строя гидравлика, засориться сгустками крови капиллярные трубки, апертура и т.д. Поэтому прибор должен работать с источником бесперебойного питания, который должен обеспечить возможность окончания анализа и промывку прибора, т.е. работу прибора в течение нескольких минут.
Периодически необходима калибровка по стандартным материалам, так как электронные и механические компоненты прибора, датчиков, насосов и т.д. со временем подвергаются старению и меняют свои технические параметры. Для осуществления калибровки необходимо пользоваться только качественными контрольными материалами!
Важно. Гематологические анализаторы очень чувствительны к длительным отключениям и перебоям в работе, что связано с подсыханием шлангов, проростом микрофлоры, кристаллизацией из растворов. При длительной остановке (на период отпуска, переезда или отсутствия реагентов) обязательным является заполнение шлангов консервирующими растворами с последующей многократной отмывкой от них.
Общее правило - не прерывать работу гематологического анализатора на длительный срок.
Чего не могут гематологические анализаторы
1. Точно дифференцировать и подсчитывать незрелые формы гранулоцитов.
2. Подсчитать бластные клетки.
3. Выявить неожиданный результат (находки)
4. Обучаться, т.е. сделать больше того, что в них заложено конструктором и программистом.
5. Полностью заменить микроскоп и мазок крови.
28. Цитохимические исследования лейкоцитов в клинике (ЩФ, гликоген, липиды, миелопероксидаза, неспецифическая эстераза). Кл-диагн. значение.
Цитохимические исследования проводят в препаратах (мазках или отпечатках) костного мозга, крови, различных органов и новообразований, пунктатов; они основаны на использовании специфических химических цветных реакций для определения в клетках различных веществ (под действием специально подобранных реактивов происходит окрашивание тех или иных веществ в цитоплазме, а по степени и характеру окраски судят о количестве или активности исследуемых веществ).
Цитохимические методы доступны и сравнительно просто выполняются. Они имеют преимущества перед биохимическими методами исследований, поскольку объектом изучения является не столь гетерогенная популяция как при биохимических исследованиях и, кроме того, в мазках крови можно одновременно оценивать состояние тех или иных катаболических и анаболических процессов в соответствующих клеточных элементах, но уступают им (биохимическим методам) в точности.
Оценка результатов
При цитохимическом исследовании чаще пользуются полуколичественной оценкой результатов, используя принцип Астальди, основанный на выявлении различной степени интенсивности специфической окраски. В зависимости от нее исследуемые элементы делят на 4 группы:
с отрицательной реакцией (-),
слабоположительной ( + ),
положительной (++),
резко положительной ( +++ ).
Для количественного выражения результатов подсчитывают 100 клеток определенного вида, дифференцируя их по указанному принципу, затем число клеток с одинаковой интенсивностью окраски умножают на соответствующее данной группе число плюсов, сумма этих произведений составляет условные единицы. Например, при исследовании активности щелочной фосфатазы в нейтрофилах из 100 просмотренных клеток в 60 клетках активность фермента не выявлена (—), в 35—специфическая окраска была слабой ( + ) и в 5— более интенсивной ( + + ). Результат определения активности щелочной фосфатазы в нейтрофилах в таком случае составит (60 Х О)+(35 X 1) + (5 X 2) = 0 + 35+ 10 = 45 ед.
Можно выразить результат в виде среднего цитохимического показателя по L. Kaplow (1955) или среднего цитохимического коэффициента (СЦК). С этой целью также дифференцируют 100 исследуемых клеток по указанной выше системе. Полученный процент клеток в каждой группе умножают на соответствующее данной группе число плюсов. Сумма этих величин, деленная на 100, представляет собой СЦК для одной клетки. В указанном примере СЦК щелочной фосфатазы нейтрофилов равен 0,45.
В тех случаях, когда изучаемые вещества локализуются в клетках в виде единичных гранул (например, активность неспецифической эстеразы в лимфоцитах и др.), результат цитохимической реакции целесообразно выражать в процентах клеток, дающих положительную реакцию.
Метод полуколичественной оценки является ориентировочным, но позволяет сравнивать распределение исследуемых веществ в разных клеточных элементах или в одних и тех же клетках при различных патологических состояниях организма, а также в зависимости от течения заболевания, степени его тяжести и в связи с проводимой терапией.
Наиболее распространены цитоэнзиматические исследования, дающие возможность выявить в клетках активность различных ферментов. Для этого чаще используют методы азосочетания, в которых специфический субстрат, взаимодействуя с ферментом, образует продукт реакции, который окрашивается солями диазония; по окраске судят о локализации фермента и его активности.
Общий принцип этих реакций в том, что в микроскоп видны не сами белковые ферменты, а места их локализации, которые обнаруживаются по продуктам их специфической ферментативной активности.
Количество конечного продукта цитохимической реакции можно определить с помощью метода цитофотометрии. Основу его составляет определение количества химических веществ по поглощению ими света определенной длины волны. Было найдено, что интенсивность поглощения лучей пропорциональна концентрации вещества при одной и той же толщине объекта. Следовательно, оценивая степень поглощения света данным веществом, можно узнать его количество. Для такого рода исследований используют приборы - микроскопы-цитофотометры; у них за объективом расположен чувствительный фотометр, регистрирующий интенсивность прошедшего через объект светового потока. Зная площадь или объем измеряемой структуры и значение поглощения, можно определить как концентрацию данного вещества, так и его абсолютное содержание.
ЩЕЛОЧНАЯ ФОСФАТАЗА (К.Ф.3.1.3.1.) содержится преимущественно в зрелых нейтрофильных лейкоцитах; активность фермента связывают со вторичными (специфическими) гранулами цитоплазмы. Относится к группе гидролитических ферментов с оптимумом действия при рН 9,6, осуществляет гидролиз однозамещенных эфиров ортофосфата. Наиболее распространено определение активности фермента методами азосочетания.
Метод азосочетания по Кеплоу.
Принцип. Расщепление щелочной фосфатазой а-нафтилфосфата с освобождением а-нафтола, образующего с солями диазония нерастворимый окрашенный в коричневый цвет осадок в местах локализации фермента.
Реактивы.1. 10% раствор формалина в абсолютном метаноле. 2. 0,05 М раствор пропандиолового буфера (рН 9,75); готовят основной 0,2 М раствор (10,5 г 2-амино-2-метил-1,3-пропандиола растворяют в 500 мл дистиллированной воды), хранят его в холодильнике. Из основного раствора готовят 0,05 М раствор (25 мл основного раствора буфера смешивают с 5 мл 0,1 н. раствора НС1 и доводят дистиллированной водой до 100 мл), хранят в холодильнике. 3. а-Нафтилфосфат. Можно использовать нафтол-АS-Фосфат, нафтол-АS-ТR-фосфат или нафтол-АS-В1-фосфат. 4. Прочный синий RR; можно использовать отечественные красители диазоль синий 2С и диазоль синий 0. 5. 2 % раствор метилового зеленого. 6. Инкубационная среда (готовят перед употреблением): 35 мг а-нафтилфосфата, 35 мг прочного синего RR, 35 мл буферного раствора.
Спец. оборудование. Холодильник.
Ход определения. Высохшие на воздухе мазки фиксируют в 10 % растворе формалина в абсолютном метаноле при температуре 0-5 °С в течение 30 с. На высохшие мазки наносят инкубационную среду после фильтрования и оставляют мазки при комнатной температуре на 8—10 мин. Ополаскивают в проточной воде в течение 10 с. Докрашивают метиловым зеленым в течение 15 мин или гематоксилином Майера 3—4 мин.
Метод азосочетания (модификация М. Г. Шубича).
Принцип. см. метод азосочетания по Кеплоу.
Реактивы. I. 0,5 % раствор целлоидина в смеси равных количеств абсолютного спирта и эфира. Целлоидин можно готовить из кино- и фотопленок по методике Меркулова: удалить слой эмульсии после вымачивания в горячей воде или щелочи, выдержать 5—10 дней в трех сменах хлороформа, промыть спиртом, высушить, мелко нарезать и растворить в смеси абсолютного спирта с эфиром. 2. 0,5 М раствор тетрабората рН 9,18 [19,1 г тетрабората натрия (бура) растворить и довести дистиллированной водой до 1 л]. Раствор стойкий. 3. 0,1 % раствор а-нафтилфосфата в растворе тетрабората (готовят перед употреблением). 4. 0,2 % раствор диазоля синего 0 в растворе тетрабората (готовят перед употреблением и фильтруют в защищенном от света месте). 5. Гематаль 8 Бейкера: один объем 0,1 % гематеина, приготовленного на 50 % водном растворе этиленгликоля, смешивают с одним объемом 1,6 % водного раствора сульфата алюминия. Вместо гематаля можно использовать гематоксилин: 1 г краски растворяют в 50 мл дистиллированной воды, доводят до кипения, доливают 50 мл дистиллированной воды, добавляют 0,02 г йодата натрия и 5 г алюмокалиевых квасцов, встряхивают до растворения и охлаждают. 6. Инкубационная среда (готовят перед употреблением); равные количества реактивов 3 и 4.
Спец. оборудование. Холодильник.
Ход определения. Мазки фиксируют в 0,5 % растворе целлоидина в течение 3—5 с. После фиксации целлоидин с обратной стороны предметного стекла удаляют салфеткой, стеклставят в вертикальном положении на фильтровальную бумагу и дают им высохнуть. Инкубируют в инкубационной среде при комнатной температуре в защищенном от света месте в течение 30 мин. Промывают в проточной воде в течение 5—10 мин и ополаскивают в дистиллированной воде. Докрашивают ядра красителем (реактив 5). При использовании гематаля 8 мазки окрашивают 18—24 ч, затем ополаскивают в дистиллированной и проточной воде и высушивают. При использовании гематоксилина мазки окрашивают 30—60 мин, ополаскивают в тетраборатном буфере, разведенном водопроводной водой, промывают водой и высушивают.
Норма. У здоровых людей большинство сегментоядерных нейтрофилов являются фосфатазоотрицательными и только в 20—30 % клеток выявлена слабая активность фермента (+) По данным М. Г. Шубича и Б. С. Нагоева, активность фосфатазы для здоровых обоего пола составляет 26 ± 0,6 ед., или СЦК 0,26 ± 0,006. Выявлено достоверное различие между показателями энзиматической активности у мужчин и женщин (соответственно 21 ± 0,7 и 31 ± 0,8 ед.).
Кдз. Наибольшее диагностическое значение имеет определение активности фермента при гемобластозах; снижение активности характерно для хронического миелолейкоза, повышение — рассматривают как один из признаков эритремии. Повышение активности наблюдается также при воспалительных процессах, интоксикациях, опухолях, коллагенозах, циррозах печени. Показатель может быть использован как дифференциально-диагностический признак при лейкемоидных реакциях (активность фермента повышена) и хроническом миелолейкозе. Снижение активности фермента часто сопутствует вирусному гепатиту, инфекционному мононуклеозу и другим вирусным инфекциям, лучевой болезни.
ПЕРОКСИДАЗА (МИЕЛОПЕРОКСИДАЗА) (К.Ф.1.11.1.7). Фермент, локализующийся преимущественно в специфической зернистости цитоплазмы гранулоцитов и являющийся маркером клеток миелоидной природы. Миелопероксидаза разрушает токсическую перекись водорода, образующуюся внутриклеточно в процессе жизнедеятельности клеток.
Метод Грэхема — Кнолля.
Принцип. В присутствии пероксидазы бензидин окисляется перекисью водорода в коричневый оксибензидин.
Реактивы 1. 4% формалиново-спиртовой раствор (10 частей 40 % формалина и 90 частей 96 % спирта). 2. Реактив на пероксидазу: бензидин (на кончике ножа) растворяют в 6 мл 96 % спирта, прибавляют 4 мл воды и 0,02 мл 3 % перекиси водорода. Реактив годен к употреблению в течение 5—6 дней. 3. Краситель Романовского — Гимзы.
Спец. оборудование. Не требуется.
Ход определения.Свежие мазки (1-2-дневной давности) фиксируют 4 % формалиново-спиртовым раствором в течение 30 с. Обмывают в проточной воде и высушивают. Заливают реактивом на пероксидазу на 5 мин. Тщательно промывают в проточной воде и высушивают. Докрашивают красителем Романовского-Гимзы. Пероксидаза выявляется в цитоплазме клеток в виде коричневых гранул.
Модифицированный метод Нарциссова.
Принцип см метод Грэхема — Кнолля. Для уменьшения инактивации фермента использованы соответствующий фиксатор и небольшое количество перекиси водорода.
Реактивы. 1. 60 % водный раствор ацетона. 2. 0,1 М раствор бората натрия (можно использовать фосфатный или мединаловый буферный раствор рН 7.6). 3. 5 % водный раствор трилона Б. 4. Насыщенный водный раствор бензидина. 5. 0,003 % раствор перекиси водорода (разводят перед употреблением из 3 % раствора в два этапа). 6. Инкубационная среда: мл 5 % водного раствора трилона Б, 10 мл раствора бората натрия, 35 мл насыщенного раствора бензидина и 2 мл раствора перекиси водорода. 7. 0,5 % раствор метилового зеленого на буферном растворе (рН 5,0) или 0,1 % водный раствор метиленового синего.
Спец. оборудование. Термостат.
Ход определения. Свежеприготовленные мазки фиксируют в 60 % водном растворе ацетона в течение 30 с. Промывают дистиллированной водой. Инкубируют в инкубационной среде в течение 1 ч в термостате при 37 °С. Промывают дистиллированной водой. Докраши-вают мазки метиловым зеленым или метиленовым синим в течение 10 мин. Можно исследовать недокрашенные мазки.
Модифицированный метод (Шафран М. Г. и соавт., 1979).
Принцип см. Метод Грэхема — Кнолля. Бензидин заменен О-дианизидином.
Реактивы. 1. 10% спиртовой раствор формалина (1 мл 10 % формалина и 9 мл этилового спирта). 2. Спиртовой раствор О-дианизидина (можно использовать препарат Шосткинского завода химреактивов; белые или желтоватые кристаллы препарата быстро окисляются на воздухе, при изменении окраски он становится непригодным). 24 мг О-дианизидина растворяют в 5 мл метанола и доводят дистиллированной водой до 9,9 мл. 3. 3 % раствор перекиси водорода. 4. Реакционная смесь: к спиртовому раствору О-дианизидина прибавляют перед употреблением 0,1 мл перекиси водорода. 5. 0,25 % водный раствор азура А или другой ядерный краситель.
Спец. оборудование. Не требуется.
Ход определения. Мазки фиксируют спиртовым раствором формалина в течение 10—15 с. Споласкивают проточной водой. На мазки наносят реакционную смесь на 2—3 мин при комнатной температуре. Споласкивают проточной водой. Докрашивают раствором азура в течение 10—15 с. Споласкивают проточной водой и высушивают.
Норма.В крови здоровых людей активность пероксидазы выявляется преимущественно в цитоплазме гранулоцитов и в меньшей степени — моноцитов. Фермент появляется в кровяных клетках на стадии промиелоцитов и у ряда миелобластов (более зрелых). Не содержат фермента недифференцированные бласты, часть миелобластов и лимфо бласты; 3—16 % нейтрофилов окрашены резко положительно (+++). 60—90 % — положительно (++) и остальные—слабоположительно (+). СЦК нейтрофилов здоровых людей равен 2,56 + 0,033. Эозинофилы характеризуются резко положительной реакцией на пероксидазу.
Кдз. Активность фермента в нейтрофилах снижена при инфаркте миокарда, ревматизме, туберкулезе, опухолях. У больных хроническим миелолейкозом, особенно в терминальной стадии, СЦК снижается до 1,63 ± 0,19 ед. В бластных клетках активность фермента высокая при остром миелобластном лейкозе, слабая — при остром монобластном и отсутствует — при остром лимфобластном лейкозе.
НЕСПЕЦИФИЧЕСКИЕ ЭСТЕРАЗЫ. Группа ферментов, гидролизующих эфиры карбоновых кислот; отличаются небольшой специфичностью. Локализуются в цитоплазме клеток, главным образом в лизосомах. Наибольшая активность обнаружена в моноцитах крови. Для определения активности ферментов используют различные субстраты (а-нафтилацетат, нафтол-AS-ацетат, нафтол-АS-D-хлорацетат, b-нафтил-ацетат и др.).
а-Нафтилацетат-эстераза (метод Леффлера).
Принцип Соединение а-нафтилацетата при определенных рН и температуре под влия- нием неспецифических эстераз гидролизуется с образованием свободного нафтола, который с солями диазония дает цветное окрашивание.
Реактивы. 1. Формалин промышленного производства (40%). 2. а-Нафтилацетат. 3. Ацетон х. ч. 4. 0,1 М раствор фосфатного буфера (рН 7,8—8,0). 5. Прочный синий ВВ (или проч-ный красный ТР). 6. Ядерный краситель (гемалаун кислый, метиловый зеленый и пр.). 7. Инкубационная среда: 10 мг а-нафтилацетата, растворенного в 0,2 мл ацетона; 40 мл буферного раствора (реактив № 4), встряхивают до растворения; 50 мг соли диазония (реактив № 5), встряхивают до растворения и фильтруют.
Спец. оборудование. 1. Весы. 2. Эксикатор.
Ход определения. Свежеприготовленные и высушенные на воздухе мазки фиксируют в парах формалина 4 мин (фиксированные препараты можно сохранять в холодильнике несколько недель или 2 сут при комнатной температуре). Инкубируют в инкубационной среде при комнатной температуре 30 мин. Промывают в проточной воде (2—3 мин). Докрашивают кислым гемалауном 8 мин. Промывают дистиллированной водой 15 мин. Активность фермента выявляется в виде коричнево-черных (при употреблении прочного синего) или красно-коричне-вых (при употреблении прочного красного) гранул в цитоплазме клеток.
Норма.В моноцитах периферической крови активность фермента содержится в виде мелкой обильной зернистости. СЦК в моноцитах составляет 0,95 ± 0,01. Небольшое количество лимфоцитов (18,0 ± 0,4 %) содержит активность фермента в виде единичных гранул в цитоплазме; в тромбоцитах периферической крови фермент выявляется в виде мелких гранул, в сегментоядерных нейтрофилах его активность ничтожна. Среди костномозговых элементов наибольшую активность имеют промиелоциты, миелоциты, мегакариоциты, моноциты, ретикулярные клетки. В моноцитах периферической крови и костного мозга с помощью двойной инкубации и добавления фторида натрия (NaF) в количестве 1,5 мг/мл показан NaF — чувствительный фермент.
Кдз. Снижение активности фермента в моноцитах и увеличение в лимфоцитах обнаружено при диффузных пора жениях печени. Значительная активность фермента выявлена в миеломных клетках при плаз- моцитоме, в властных клетках при остром мо- нобластном (гистиомонобластном) лейкозе и при промиелоцитарном лейкозе, в то время как при остальных формах острых лейкозов актив- ность фермента в бластных клетках ничтожна. При хроническом лимфолейкозе активность фермента в лимфоцитах резко снижена. Ферментативная активность нейтрофилов при острых лейкозах, особенно при остром миелобластном, снижена.
КИСЛАЯ а-НАФТИЛАЦЕТАТ-ЭСТЕРАЗА.
Фермент локализуется главным образом в лизосомах цитоплазмы клеток и участвует в гидролизе алифатических эфиров.
Метод Кулленкампфа и соавт.
Принцип. Из соединения а-нафтилацетата при кислом рН под влиянием фермента образуется свободный нафтол, дающий цветное окрашивание с фуксином.
Реактивы. 1. 2,5% раствор глутаральдегида (рН 7,2). 2. 4 % раствор солянокислого фуксина. 3. 4 % раствор нитрата натрия. 4. 0,7 М фосфатный буфер (рН 5,0). 5. сх-Нафтилацетат. 6. 2 % раствор метилового зеленого. 7. Инкубационная среда: 2 мл реактива № 2, 2 мл реактива № 3, 40 мл реактива № 4. 10 мг а-нафтилацетата, растворенного в 0,4 мл ацетона. Инкубационная среда должна иметь рН 5,8 и готовиться перед употреблением.
Спец. оборудование. 1. Холодильник. 2. Весы. 3. Эксикатор.
Ход определения. Высушенные на воздухе мазки фиксируют в глутаральдегиде (реактив № 1) при температуре 4 °С в течение 10 мин (нефиксированные мазки можно хранить в холодильнике 1—2 мес). Промывают дистиллированной водой. Инкубируют в инкубационной среде в течение 1/2—6 ч. Промывают дистиллированной водой. Докрашивают метиловым зеленым.
Норма.В цитоплазме лимфоцитов активность фермента выявляется в виде темно-красных гранул, в нейтрофилах и моноцитах — в виде диффузной окраски. СЦК лимфоцитов равен 0,57 + 0,04. Активность фермента увеличивается при увеличении времени инкубации. Так, при инкубации в течение 1/2 ч активность фермента выявлена в 49,83 ± 2,75 % лимфоцитов, при удлинении срока инкубации до 6 ч эстеразоположительными становятся 79,7 ± 1,52% лимфоцитов. Использование в качестве фиксатора формалина дает более стабильные результаты.
Кдз. Снижение активности фермента в лимфоцитах характерно для хронического лимфолейкоза (В-клеточного варианта); при Т-клеточных пролиферациях активность неспецифической кислой эстеразы в лимфоцитах повышена.
НАФТОЛ-AS АЦЕТАТ-ЭСТЕРАЗА.
Метод Леффлера.
Принцип и Спец. оборудование. такие же, как для определения а-нафтилацетат-эстеразы.
Реактивы. 1. Формалин промышленного производства (40 %). 2. 0,1 М фосфатный буфер (рН 6,8—7,0). 3. Ацетон х. ч. 4. Нафтол-AS- ацетат (можно использовать нафтол-АS-D-ацетат). 5. Прочный синий ВВ. 6. Ядерный краситель. 7. Инкубационная среда: 4 мг нафтолAS-ацетата, растворенного в 0,4 мл ацетона, 40 мл буферного раствора (реактив № 2); встряхивают и добавляют 80 мг прочного синего ВВ, встряхивают и фильтруют.
Ход определения. Высушенные на воздухе (в течение 1—3 ч) мазки фиксируют в парах формалина несколько минут. Помещают в инкубационную среду на 60 мин при комнатной температуре. Промывают в проточной воде. Докрашивают ядерным красителем.
Норма.Так же, как и а-нафтил-эстераза, фермент локализуется главным образом в моноцитах крови. По сравнению с активностью а-нафтилацетат-эстеразы активность нафтол-АS-ацетат-эстеразы в сегментоядерных нейтрофилах несколько выше, а в лимфоцитах — слабее. В клетках костного мозга фермент обнаружен в мегакариоцитах, ретикулярных и плазматических клетках, а также незрелых гранулоцитах.
Кдз. Значительная активность фермента характерна для бластных клеток при остром монобластном (гистиомонобластном) лейкозе, при остром промиелоцитарном лейкозе; при других формах острых лейкозов активность фермента в бластных клетках не выявляется.
НАФТОЛ-AS D-ХЛОРАЦЕТАТ-ЭСТЕРАЗА.
Метод Молони с соавт.
Принцип и обор у д о в а н и е такие же, как для определения а-нафтилацетат-эстеразы.
Реактивы. 1. 10% раствор формалина в метаноле (сохраняют в холодильнике). 2. Буферный раствор Михаэлиса (рН 7,4). 3. Нафтол-АS-D-хлорацетат. 4. Ацетон х. ч. 5. Гранатовый прочный GBC или синий прочный ВВ. 6. Ядерный краситель. 7. Инкубационная среда: 10 мг нафтол-АS-D-хлорацетата, растворенного в 0,5 мл ацетона, 10 мл буферного раствора (реактив № 2), разведенного пополам дистиллированной водой (добавляют по каплям), 10 мг реактива № 5; быстро встряхивают во избежание образования осадка, смесь фильтруют.
Спец. оборудование. Не требуется.
Ход определения. Свежеприготовленные и высушенные на воздухе мазки фиксируют в холодном 10 % растворе формалина в метаноле в течение 30 с и затем высушивают. Фиксированные препараты можно сохранять несколько месяцев. Помещают в инкубационную смесь при комнатной температуре на 30 мин. Промывают в проточной воде. Докрашивают ядерным красителем.
Норма.Фермент выявляется в виде синих или фиолетовых гранул в цитоплазме сегментоядерных нейтрофилов, лимфоциты и моноциты фермента не содержат. В мазках пунктата костного мозга здоровых людей наибольшую активность фермента обнаруживают в промиелоцитах. По мере созревания гранулоцитов активность нафтол-АS-D-хлор- ацетат-эстеразы несколько снижается, но остается довольно высокой. Наиболее высокая интенсивность реакции наблюдается при фиксации в парах формалина при комнатной температуре. Время фиксации до 10 мин не оказывает влияния на уровень активности фермента, лишь при фиксации в течение 30 мин и дольше активность фермента снижается.
Кдз. Высокая активность фермента обнаружена в властны клетках при промиелоцитарном остром лейкозеничтожная — при остром монобластном; при других формах острых лейкозов в властных клетках активность не выявлена.
ГЛИКОГЕН локализуется в цитоплазме клеток и играет важную роль в энергетическом метаболизме клеток. При цитохимическом исследовании гликогена используют главным образом PAS- или ШИК-реакцию (по названию реактивов— шифф-йодная кислота).
Метод Шабадаша.
Принцип Под влиянием периодата калия гликоген окисляется с образованием альдегидных соединений, легко реагирующих с реактивом Шиффа (фуксин-сернистая кислота). В местах локализации гликогена выявляется вишнево-фиолетовое окрашивание.
Реактивы. 1. 0,03 М раствор периодата калия или натрия: 230 мг периодата растворяют в 100 мл дистиллированной воды. Готовят перед употреблением. 2. 1 н. НС1: 82,5 мл концентрированной НС1 отн. плотности 1,19 доливают дис- тиллированной водой до 1 л. 3. Основной фуксин (для фуксин-сернистой кислоты). 4. Метабсульфит калия. 5. Реактив Шиффа; 1 г основного фуксина растворяют в 200 мл кипящей дистиллированной воды. По мере охлаждения в раст-вор добавляют 1 г метабисульфита калия и 20 мл 1 н. НС1. Оставляют на сутки. Для полного обесцвечивания добавляют растолченную таблетку карболена, оставляют на сутки, затем фильтруют. Реактив сохраняют в темноте (лучше на холоде) в плотно закрытой посуде. Годен к употреблению в течение нескольких месяцев (легкая степень покраснения свидетельствует о непригодности реактива). 6. Сернистая вода: к 10 мл 10 % раствора метабисульфита калия добавляют 200 мл дистиллированной воды и 10 мл 1 н. HCI. Готовят перед употреблением. 7. 0,1 % спиртовой раствор светло-зеленой краски (лихтгрюн).
Спец. оборудование. 1. Горелки. 2. Термостат. 3. Весы.
Ход определения. Препараты фиксируют (тотчас после приготовления) в абсолютном спирте в течение 30 мин. Промывают в двух сменах дистиллированной воды. Погружают в раствор периодата на 20 мин (в темноте). Промывают в трех сменах дистиллированной воды. Ополаскивают в сернистой воде (в течение 1 — 2 мин). Окрашивают реактивом Шиффа в течение 30—40 мин (в темноте). Промывают в трех сменах сернистой воды по 3 мин. Промывают в трех сменах дистиллированной воды по 3 мин. Окрашивают светло-зеленой краской в течение 10—20 с. Промывают в дистиллированной воде. Гликоген окрашивается в вишнево-фиолетовый цвет на зеленом фоне препарата. Кроме гликогена, положительную реакцию могут давать такие ШИК-положительные вещества, как кислые и нейтральные мукополисахариды, мукопротеины, гликопротеины и др. Гликоген легко отдифференцировать от других веществ пробой со слюной или диастазой.
Проба со слюной. Препарат помещают в свежесобранную слюну и оставляют на 30 мин в термостате. Затем производят окраску на гликоген приведенным выше методом. Инкубация препаратов со слюной способствует расщеплению гликогена, и при реакции с реактивом Шиффа не получается розовой окраски. Идентифицировать гликоген можно также путем предварительной инкубации мазков с диастазой (а-амилаза; К. Ф. 3.2.1.1) (1 мл профильтрованной диастазы растворить в 40 мл изотонического раствора хлорида натрия) в течение 30 мин в термостате.
Норма.В мазках периферической крови гликоген содержится в цитоплазме нейтрофилов (в виде обильной мелкой зернистости), цитоплазме лимфоцитов (в виде небольшого количества крупных зерен). В пунктате костного мозга гликоген выявляется в нейтрофилах разной степени зрелости, лимфоцитах и мегакариоцитах. У здоровых людей количество интенсивно окрашенных нейтрофилов крови (+++) колеблется в пределах 2—12 %, средней интенсивности окраски (++)—в пределах 72—90%, слабо окрашенных (+) —от 4 до 18%. СЦК равен 1,71-2,04.
В лимфоцитах крови здоровых людей гликоген содержится в виде небольшого числа гранул в 10,4 ± 2,3 % клеток. В мегакариоцитах костного мозга гликоген обнаруживается в виде гранул (от единичных до 30—50), напоминая скопления кровяных пластинок. У здоровых людей число гликогенположительных мегакариоцитов составляет 62,0 ± 3,55 %.
Кдз. Увеличение содержания гликогена в нейтрофилах наблюдается при различных воспалительных процессах, эритремии, сахарном диабете, уменьшение — при агранулоцитозах, лучевой болезни, при хроническом миелолейкозе, особенно при прогрессировании процесса. Повышение числа гликогенположительных лимфоцитов (до 70— 80 %) характерно для лимфопролиферативных заболеваний, особенно хронического лимфолейкоза. При тромбоцитопенической пурпуре и сим-птоматических тромбоцитопениях число гликогенположительных форм мегакариоцитов значительно снижено, после спленэктомии оно повышается до нормальных величин. При острых лейкозах гликоген можно обнаружить в властных клетках: при остром миелобластном лейкозе — в виде мелкой зернистости в цитоплазме или в виде диффузного ее окрашивания, при остром лимфобластном лейкозе — в виде крупных гранул, расположенных в цитоплазме вокруг ядра, при остром монобластном варианте бластные клетки содержат гликогена немного в виде диффузной окраски, при эритромиелозе гликоген в виде гранул обнаруживается в эритробластах.
ЛИПИДЫ локализуются в цитоплазме клеток главным образом в мембранах органелл и обнаруживаются преимущественно в нейтрофильных гранулоцитах. Играют важную роль, в проницаемости мембран. Цитохимическое исследование основано на применении красящих веществ, растворяющихся в жирах (судан III , судан IV, черный судан и др.). Для выявления нейтрального жира пользуются судаком III , окрашивающим жир в оранжевый цвет. Липоиды выявляются лучше Суданом черным (черное окрашивание).
Окраска суданом III (метод Гольдмана).
Принцип Растворение жиров и окраска суданом III в оранжевый цвет.
Реактивы. 1. Формалиновый спирт (1 часть формалина и 4 части 96% спирта). 2. 70 % этиловый спирт (к 100 мл 96 % спирта прибавить 39,18 мл дистиллированной воды). 3. сх-Нафтол. 4. Раствор Судана (к 100 мл 70 % спирта добавляют 20 мл дистиллированной воды, 1,2 г а-нафтола и в избытке судан III. Раствор кипятят в течение 10 мин и фильтруют). 5. Краситель Романовского — Гимзы.
Спец. оборудование. не требуется.
Ход определения.. Мазки крови фиксируют в формалиновом спирте в течение 1 — 3 мин. Красят в растворе Судана III в течение 10 мин. Помещают в 70 % этиловый спирт на 1 мин. Докрашивают красителем Романовского — Гимзы или гематоксилином в течение 5—10 мин. Промывают дистиллированной водой. Липиды выявляются в виде оранжевых зерен.
Норма.В мазках периферической крови липиды содержатся в цитоплазме нейтрофилов в виде обильной зернистости. Большинство нейтрофилов (69—80%) у здоровых людей красятся интенсивно (+++). 18—36 % дают окраску средней интенсивности (++) и 10% слабо окрашены (+). СЦК липидов в неитрофилах 2,65 ± 0,033. В мазках костного мозга в миелобластах обнаружено небольшое содержание липидов, в промиелоцитах их больше и по мере созревания нейтрофилов содержание липидов увеличивается.
Кдз. Повышение содержания липидов в неитрофилах наблю- дается при острых лейкозах и обострении хронических лейкозов. При острых лейкозах липиды в властных клетках обнаружены у больных при миелобластном и монобластном вариантах и не выявлены при лимфобластном остром лейкозе. При недифференцированном остром лейкозе властные клетки лишь в небольшом количестве(2,2 ± 0,82 %) содержат липиды. Уменьшение липидов в неитрофилах выявлено при ревматизме, воспалительных процессах.
Из кафедральной методы
ЩЕЛОЧНАЯ ФОСФОТАЗА
О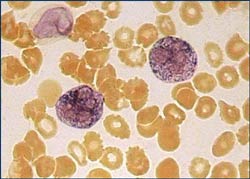 пределение
активности (индекса) щелочной фосфатазы
применяется для цитохимической
дифференциации хронической миелоидной
лейкемии от других заболеваний
миелопролиферативного типа.
пределение
активности (индекса) щелочной фосфатазы
применяется для цитохимической
дифференциации хронической миелоидной
лейкемии от других заболеваний
миелопролиферативного типа.
Принцип реакции:
В основе лежит метод азосочетания – расщепление щелочной фосфатазой альфа- нафтилфосфата с освобождением альфа-нафтола, образующего с солями диазония нерастворимый окрашенный в коричневый цвет осадок в местах локализации фермента.
ГЛИКОГЕН
PAS-реакция
Механизм РАS-реакции основан на окислении йодной кислотой гликолевых групп или их амино- или алкиламино- производных до альдегидов. Альдегидные группировки при взаимодействии с реактивом Шиффа образуют продукт красного цвета (метод Mc Manus).
Мукополисахариды (новое название – гликозамингликаны) определяются во всех морфологически идентифицируемых клетках гранулоцитарного ряда. Концентрация PAS-положительного материала в клетках гранулоцитопоэза нарастает по мере созревания клеток. Диффузное окрашивание цитоплазмы обычно свойственно наиболее молодым клеткам гранулоцитарного ряда (миелобласты, промиелоциты, миелоциты). В зрелых нейтрофилах содержится много PAS-положительного вещества в виде мелких гранул, упакованных так плотно, что цитоплазматический фон плохо различим. В зрелых эозинофилах и базофилах PAS-положительный материал располагается следующим образом: специфические гранулы остаются неокрашенными и резко выделяются на фоне диффузного окрашивания цитоплазмы.
В моноцитах PAS-положительный материал чаще выявляется в виде мелкой пылевидной зернистости на фоне светло-розового диффузного окрашивания.
В норме от 3 до 10% клеток эритроидного ряда содержат мукополисахариды.
В тромбоцитах PAS-положительный материал выявляется в виде мелких рассеянных гранул по периферии клетки либо в виде интенсивного центрально расположенного пятна.
В лимфоцитах концентрация мукополисахаридов меньше, чем в гранулоцитах. В норме 2 – 30% лимфоцитов периферической крови содержат PAS-положительный материал, располагающийся в виде гранул вокруг ядра, в 1-2% клеток гранулы могут быть интенсивно окрашены и образуют крупные блоки.
Н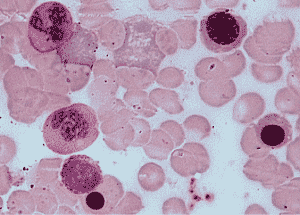 ормальные
цитохимические показатели содержания
гликогена в лейкоцитах 95–100% нейтрофилов.
PAS-реакция выявляется в диффузной форме.
От 2 до 30% лимфоцитов содержат
PAS-положительное вещество в гранулярной
форме.
ормальные
цитохимические показатели содержания
гликогена в лейкоцитах 95–100% нейтрофилов.
PAS-реакция выявляется в диффузной форме.
От 2 до 30% лимфоцитов содержат
PAS-положительное вещество в гранулярной
форме.
Диффузная PAS-реакция в нейтрофилах, гранулярная – в лимфоците.
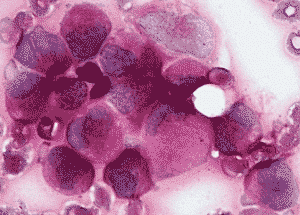 -гранулярная
PAS-реакция в бластах (М5).
-гранулярная
PAS-реакция в бластах (М5).
Клиническое значение определения PAS-реакции
При диагностике острых миелобластных лейкозов бластные клетки могут быть либо PAS-отрицательными, либо обнаруживать слабодиффузное окрашивание цитоплазмы. Яркое диффузное окрашивание цитоплазмы наблюдается только при остром промиелоцитарном лейкозе. В монобластах реакция может быть отрицательной, слабо положительной в диффузной или диффузно-гранулярной форме (когда продукт реакции выявляется в виде рассеянных мелких или средних гранул, располагающихся по краю цитоплазмы, на диффузном фоне). В то же время при ОЛЛ бласты содержат гликоген в цитоплазме в виде средних и крупных гранул, располагающихся венчиком вокруг ядра, иногда сливающихся в блоки, на неокрашенном фоне. Количество клеток с таким характером PAS-реакции сильно варьируется при различных случаях ОЛЛ.
ЛИПИДЫ
Липиды обнаруживаются практически во всех лейкоцитах, за исключением лимфоцитов. Однако основная масса липидов связана с клетками гранулоцитарного ряда. Они входят в состав специфической зернистости нейтрофильных гранулоцитов, эозинофилов и накапливаются по мере созревания клеток. В миелобластах обычно имеется небольшое количество гранул, локализующихся в перинуклеарной зоне, в промиелоцитах их становится несколько больше, в миелоцитах и метамиелоцитах содержание суданофильных гранул высокое. В зрелых нейтрофилах липиды заполняют всю цитоплазму. В моноцитах и их предшественниках часто содержится различное число мелких или умеренно крупных гранул, распределенных по всей клетке, с некоторой тенденцией к концентрированию в перинуклеарной зоне или ободке цитоплазмы. Эритрокариоциты, ретикулоциты и зрелые эритроциты не содержат суданофильных гранул. В клетках лимфоидного ряда липиды не выявляются.
С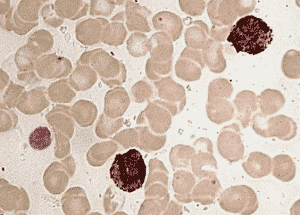 табильные
и хорошо воспроизводимые результаты
для исследования гемопоэтических клеток
получаются при применении метода с
суданом черным В по методу Sheehan и Storey.
табильные
и хорошо воспроизводимые результаты
для исследования гемопоэтических клеток
получаются при применении метода с
суданом черным В по методу Sheehan и Storey.
Нормальные величины
Большинство нейтрофилов (69-80%) у здоровых людей имеет резко выраженную, 18-36% – умеренно выраженную и 10% – слабо выраженную реакцию на липиды.
Положительная реакция на липиды в нейтрофилах и отрицательная в лимфоците.
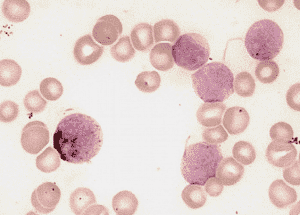
Положительная реакция на липиды в бластах (М2).
Клиническое значение определения липидов
Особую информативность реакция с суданом черным В имеет при дифференциальной диагностике острых лейкозов. Обычно липиды выявляются параллельно с миелопероксидазой, но могут обнаруживаться и в менее зрелых миелобластах при отсутствии МПО, т.е. являются более чувствительным маркером миелоидной дифференцировки.
Однако описаны крайне редкие случаи выявления липидов в лимфобластах. В соответствии с FAB-классификацией, при диагностике острых лейкозов для подтверждения миелоидной природы бластов необходимо наличие не менее 3% бластных клеток, положительных по МПО и/или липидам.
Уменьшение суданофилии с появлением отдельных сегментоядерных нейтрофилов, не содержащих липидов, отмечается при ХМЛ.
МИЕЛОПЕРОКСИДАЗА
Миелопероксидаза (МПО)
Пероксидаза является лизосомальным ферментом, катализирующим в присутствии перекиси водорода (Н2О2) окисление различных субстратов. Миелопероксидаза (МПО) локализуется преимущественно в специфических азурофильных гранулах в цитоплазме гранулоцитов и является маркером клеток миелоидного ряда. В клетках МПО участвует в реакции разрушения токсичной перекиси водорода. В цитохимических реакциях активность фермента определяется по окислению хромогенов (бензидина, о-дианизидина и др.) по методу Грехема – Кнолля.
МПО выявляется в клетках гранулоцитарного ряда начиная с миелобласта. Активность фермента нарастает по мере созревания клеток. В сегментоядерных нейтрофилах здоровых людей выявляется высокая активность МПО в виде гранул, заполняющих цитоплазму.
Самая высокая активность фермента наблюдается в зрелых эозинофилах. В базофильных промиелоцитах и миелоцитах активность МПО, как правило, высокая, однако по мере дифференцировки их в зрелые клетки активность фермента снижается. Зрелые базофилы могут быть почти отрицательными по данному признаку. Слабоположительная реакция на МПО наблюдается в различном проценте моноцитов в виде немногочисленных рассеянных гранул. В эритрокариоцитах, лимфоцитах, и мегакариоцитах МПО не определяется.
Нормальные величины
В крови здоровых людей 3 - 16% нейтрофилов имеют резко положительную, 60–90% – умеренно положительную, остальные – слабо положительную реакцию на МПО. СЦК нейтрофилов здоровых людей равен 2,56±0,33.

Положительная реакция на МПО в бластах (М3) (костный мозг).
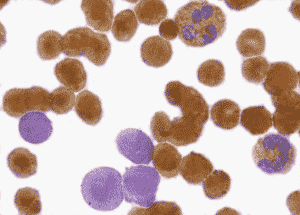
Положительная реакция на МПО в нейтрофилах и отрицательная в бластах при ОЛЛ (L2).
Клиническое значение определения МПО
Реакция используется главным образом с целью диагностики острых лейкозов. При острых миелобластных лейкозах активность фермента в опухолевых клетках варьируется от слабой до выраженной, в зависимости от степени дифференцировки бластов. Так, при острых миелобластных лейкозах с низкой степенью дифференцировки (М1 по FAB-классификации) количество МПО-положительных бластов невелико (не превышает 10%), степень активности фермента в них невысокая. При остром промиелоцитарном лейкозе (М3 по FAB-классификации) МПО выявляется практически в 100% бластных клеток, причем активность ее равноценна таковой у зрелых нейтрофилов. Однако отсутствие точных количественных способов оценки цитохимических реакций не позволяет использовать их для верификации степени дифференцировки бластных клеток, следовательно, и более тонкой дифференциальной диагностики ОЛ. Таким образом, с помощью цитохимических реакций определяют линейную направленность, а не степень дифференцировки бластов.
При острых монобластных лейкозах реакция на МПО в опухолевых клетках слабая, при острых лимфобластных – отрицательная.
НЕСПЕЦИФИЧЕСКИЕ ЭСТЕРАЗЫ
Термином «эстераза», или «неспецифическая эстераза» обозначены ферменты, способные гидролизовать простые эфиры N-свободных спиртов и органических кислот.
Неспецифические эстеразы – неоднородная группа ферментов, отличающихся друг от друга по субстратной специфичности и действию активаторов и ингибиторов. Все неспецифические эстеразы являются лизосомальными ферментами. В гематологии наиболее часто определяют a-нафтилацетатэстеразу, хлорацетатэстеразу, кислую a-нафтилацетатэстеразу (по методу Loffler). Эти ферменты получили название от субстратов, которые они гидролизуют, и от реакции среды, где они проявляют свое действие. a-нафтилацетатэстераза обнаруживается во всех клетках миелоидного ряда начиная с миелобласта. Активность ее выявляется в эозинофилах вне всякой связи с их специфической зернистостью, в небольшом числе лимфоцитов, эритрокариоцитах, мегакариоцитах и тромбоцитах. Самую интенсивную реакцию дают моноциты и макрофаги. Использование в качестве субстрата нафтил-AS или AS-D-ацетата дает положительный результат в большинстве клеток, но особенно высокая активность выявляется в моноцитах. Активность неспецифической эстеразы в клетках моноцитарного ряда легко ингибируется фторидом натрия, но не подавляется в гранулоцитах. Этот феномен позволяет отличить клетки системы мононуклеарных фагоцитов от клеток других ростков кроветворения, обладающих активностью неспецифической эстеразы. Активность нафтил-AS-D-хлорацетат-эстеразы выражена в клетках гранулоцитарного ряда и отсутствует в клеточных элементах моноцитарного и лимфоцитарного ряда. Кислая a-нафтилацетатэстераза рано выявляется в процессе дифференцировки Т-лимфоцитов и локализуется в виде фокального пятна в цитоплазме этих клеток.
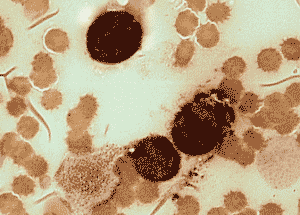
Положительная реакция на неспецифическую эстеразу в бластах (костный мозг) – о. миеломонобластный лейкоз (М4).
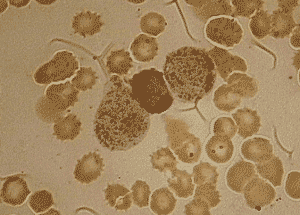
Частичное подавление неспецифической эстеразы в бластах фторидом натрия (костный мозг) – о. миеломонобластный лейкоз (М4).
Клиническое значение определения эстераз Определение активности неспецифической эстеразы используется для идентификации лейкозных моноцитарных предшественников. Эти клетки, как правило, проявляют высокую активность неспецифической эстеразы с субстратами бутират, ацетат и AS-D-ацетат, которая в значительной степени ингибируется фторидом натрия.
Реакция на нафтол-AS-D-хлорацетатэстеразу по своей надежности выявления гранулоцитарной направленности дифференцировки сравнима с пероксидазной реакцией. Реакция на a-нафтилацетатэстеразу является наиболее достоверной для идентификации монобластного и моноцитарного типов лейкозов.
Цитохимическая дифференциация острых лейкозов
-
Реакция/Тип лейкоза
M1
M2
M3
M4
M5
M6
M7
Миелопероксидаза
+
+
+
+
- / +
-
-
Неспецифич.эстеразы
-
-
- / +
+
++
+
+ / -
ШИК-реаакция
-
-
-
-
- / +
+
+
Цитохимические исследования (лекция Новиковой)
Принцип: выявление различных веществ в клетках, основанное на их реакции с красителями и появлении специфического окрашивания.
Оценивают: наличие или присутствие в клетке исследуемого вещества, особенности его расположения (диффузное, гранулярное).
Цитохимическая характеристика клеток гемопоэза возможна, начиная с бластных форм.
Зрелые гранулоциты:
миелопероксидаза++, липиды++, гликоген ++(диффуз. окраш-е), щелочная фосфатаза++.
Миелобласты:
миелопероксидаза +, неспец. эстераза +, гликоген +, щелочная фосфатаза-.
Моноциты:
неспецифическая эстераза ++, пероксидаза + - , гликоген +.
Лимфоциты:
гликоген + (гранулярное окрашивание), пероксидаза -, липиды -
Выражение результатов цитохимических реакций
Полуколичественная оценка результатов (принцип Астальди): все исследуемые клетки делят на 4 группы –
Отрицательная реакция –
Слабоположительная +
Положительная + +
Резкоположительная + + +
Подсчитывают 100 клеток, дифференцируя по степени интенсивности окраски, результата суммируют и выражают в процентах (с отсутствием реакции отнимают).
Средний цитохимический коэффициент (по Kaplow)
Пример:
Отрицательная реакция – 2
Слабоположительная + 10
Положительная ++ 25
Резкоположительная +++ 63
Расчет: (2х0)+(10х1)+(25х2)+(63х3) : 100 = 2,49
Нормы цитохимических показателей каждая лаборатория разрабатывает отдельно!
Клиническое использование цитохимических показателей
Дифференцировать различные формы лейкозов (FAB) -
Миелобластный – пероксидаза, гликоген, липиды
Монобластный – неспецифическая эстераза
Лимфобластный – гликоген
Дифференцировать хронический миелолейкоз и лейкемоидные реакции миелоидного типа – щелочная фосфатаза (ХМЛ ↓↓↓, лейкемоидная реакция - ↑↑↑).
Диагностика наследственной гемолитической анемии, обусловленной дефицитом Г-6-ФД в эритроцитах.
Выявление сидероцитов (сидеробластов).
