
- •В химическом производстве. План лекции
- •1.Введение. 2.Химическое производство
- •3.Иерархическая организация процессов в химическом производстве. 3.Классификации и категории эффективности химических производств.
- •Эффективности химических производств План лекции
- •План лекции
- •1.Сырье
- •2. Классификация химического сырья
- •3. Подготовка химического сырья к переработке
- •Классификация химического сырья
- •План лекции
- •Виды использования вторичных энергетических ресурсов
- •План лекции
- •Виды типовых технологических операторов хтс
- •Классификация и условные изображения типовых технологических операторов хтс
- •Понятие идентификации хтс план лекции
- •Понятия анализа, оптимизации и синтеза хтс
- •Лекция 7 Эксергетический баланс. Классификация химических реакторов план лекции
- •Классификация химических реакторов
- •Для реализации нулевого порядка из уравнения получают
- •Уравнение материального баланса для рис-н
- •Лекция 5
- •Реактор идеального вытеснения (рив)
- •Сравнение эффективности проточных реакторов идеального смешения и идеальног вытеснения
- •Модели реакторов с неидеалной структурой потоков
- •Скорость простой необратимой реакции n-го порядка
- •Сравнение эффективности хтп при использовании
- •Модели реакторов с неидеалной структурой потоков
- •Реакторы с различным тепловым режимом
- •Лекция 6
- •Тепловая устойчивость химических реакторов
- •Лекция 7
- •1.Гетерогенные некаталитические процессы
- •2.Лимитирующая стадия. Способы определения лимитирующей стадии
- •3.Кинетические модели системы газ - твердое вещество
- •Кинетические модели гетерогенных процессов в системе «газ- твердое вещество».
- •Внешняя диффузия. В результате протекания химической реакции
- •Константа скорости гетерогенного процесса. Лимитирующая стадия
- •Лекция 8
- •1.Лимитирующая стадия – внутренняя диффузия (газ- твердое)
- •2.Способы определения лимитирующей стадии
- •3.Гетерогенные процессы «газ- жидкость»
- •Гетерогенные процессы «газ—жидкость»
- •Массопередача между газом и жидкостью
- •Кинетические модели газожидкостных реакций
- •Лекция 9
- •1.Общие представления о катализе
- •2.Технологические характеристики твердых катализаторов
- •3.Стадийность гетерогенно каталитических процессов
- •Технологические характеристики твердых катализаторов
- •Лекция 10
- •Промышленные химико-технологические процессы
- •Классификация сточных вод
- •Лекция 11
- •1.Технология связанного азота
- •2.Синтез аммиака
- •Лекция 12
- •1.Технология азотной кислоты
- •Лекция 14
- •1.Производство метанола
- •2.Синтез этанола
- •Синтез этанола
- •План лекции
- •Производство бутадиена-1,3 дегидрированием н-бутана
- •Производство фенола кумольным методом
План лекции
1.Использование
2.Источники энергии.
3.Рациональное использование энергии в химической
промышленности
4.Новые виды энергии в химической промышленности
Использование энергии в химической промышленности.
Химическая отрасль промышленности, производя около 6% промышленной продукции, потребляет до 12% всей вырабатываемой электроэнергии.
Потребление энергии химическим производством оценивается его энергоемкостью. Энергоемкостью производства называется количество энергии, затрачиваемое на получение единицы продукции. Она выражается в кВт *ч (кДж) или в тоннах условного топлива (УТ) на тонну продукции. По энергоемкости химические производства делятся на три класса.
I класс. Производства с расходом УТ более 2 тонн (58*103 кДж) на тонну продукции.
II класс. Производства с расходом УТ от 1 до 2 тонн
(29 • 103 – 58*103 кДж) на тонну продукции,
III класс. Производства с расходом УТ менее 1 тонны (90*103 кДж) на тонну продукции.
В химическом производстве используется электрическая, тепловая, топливная, механическая, световая, ядерная и химическая энергия

 ядерное
топливо
ядерное
топливо
невозобновляемые уголь

 первичные
нефть
первичные
нефть
Э нергетичес- газ
к ие
ресурсы
ие
ресурсы

 возобновляемые
солнечная радиация
возобновляемые
солнечная радиация
гидроэнергетические ресурсы
энергия ветра
вторичные биомасса
геотермальная энергия
водородная энергетика
Вторичными энергоресурсами(ВЭР) называется энергетический потенциал конечных, побочных и промежуточных продуктов и отходов химического производства, используемый для энергоснабжения агрегатов и установок.
К ВЭР относятся тепловые эффекты экзотермических реакций, теплосодержание отходящих продуктов процесса, а также потенциальная энергия сжатых газов и жидкостей.
Структура потребления химического топлива:
газ - 19,4%
твердое топливо - 30,9%,
Нефтепродукты- 47,2%.
Использование водорода в качестве источника энергии определяется следующими его преимуществами как топлива:
- распространением водорода (в литосфере 17 атомов на 100 атомов) и практически неисчерпаемыми запасами воды, как источника водорода;
- высоким энергосодержанием, превышающим в 3,5 раза энергосодержание нефти;
- простотой и дешевизной транспортировки (передача водорода дешевле передачи электроэнергии);
- экологической чистотой продуктов сгорания.
Э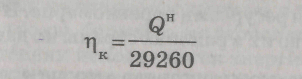 нергетическая
ценность химического топлива
характеризуется:
нергетическая
ценность химического топлива
характеризуется:
калорийным эквивалентом
где Q – теплота сгорания данного топлива,
29260 – теплота сгорания Условного Топлива(УТ)
- количеством энергии в кВт-ч, получаемой при полном сгорании 1 кг или 1 нм3 топлива
Критерием экономичности использования энергии всех видов является коэффициент использования энергии, равный отношению количества энергии, теоретически необходимой на производство единицы продукции (Wт), к количеству энергии, практически затраченной на это (Wп):
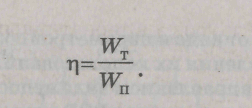
Вторичные Энергетические Ресурсы подразделяются на
- горючие (топливные),
представляющие химическую энергию отходов технологических процессов переработки топлива и горючих газов металлургии;
- тепловые, представляющие физическую теплоту отходящих газов и (Жидкостей технологических агрегатов и отходов основного производства,
- избыточного давления, представляющие потенциальную энергию газов и жидкостей, выходящих из технологических агрегатов, работающих под избыточным давлением.
