
- •В химическом производстве. План лекции
- •1.Введение. 2.Химическое производство
- •3.Иерархическая организация процессов в химическом производстве. 3.Классификации и категории эффективности химических производств.
- •Эффективности химических производств План лекции
- •План лекции
- •1.Сырье
- •2. Классификация химического сырья
- •3. Подготовка химического сырья к переработке
- •Классификация химического сырья
- •План лекции
- •Виды использования вторичных энергетических ресурсов
- •План лекции
- •Виды типовых технологических операторов хтс
- •Классификация и условные изображения типовых технологических операторов хтс
- •Понятие идентификации хтс план лекции
- •Понятия анализа, оптимизации и синтеза хтс
- •Лекция 7 Эксергетический баланс. Классификация химических реакторов план лекции
- •Классификация химических реакторов
- •Для реализации нулевого порядка из уравнения получают
- •Уравнение материального баланса для рис-н
- •Лекция 5
- •Реактор идеального вытеснения (рив)
- •Сравнение эффективности проточных реакторов идеального смешения и идеальног вытеснения
- •Модели реакторов с неидеалной структурой потоков
- •Скорость простой необратимой реакции n-го порядка
- •Сравнение эффективности хтп при использовании
- •Модели реакторов с неидеалной структурой потоков
- •Реакторы с различным тепловым режимом
- •Лекция 6
- •Тепловая устойчивость химических реакторов
- •Лекция 7
- •1.Гетерогенные некаталитические процессы
- •2.Лимитирующая стадия. Способы определения лимитирующей стадии
- •3.Кинетические модели системы газ - твердое вещество
- •Кинетические модели гетерогенных процессов в системе «газ- твердое вещество».
- •Внешняя диффузия. В результате протекания химической реакции
- •Константа скорости гетерогенного процесса. Лимитирующая стадия
- •Лекция 8
- •1.Лимитирующая стадия – внутренняя диффузия (газ- твердое)
- •2.Способы определения лимитирующей стадии
- •3.Гетерогенные процессы «газ- жидкость»
- •Гетерогенные процессы «газ—жидкость»
- •Массопередача между газом и жидкостью
- •Кинетические модели газожидкостных реакций
- •Лекция 9
- •1.Общие представления о катализе
- •2.Технологические характеристики твердых катализаторов
- •3.Стадийность гетерогенно каталитических процессов
- •Технологические характеристики твердых катализаторов
- •Лекция 10
- •Промышленные химико-технологические процессы
- •Классификация сточных вод
- •Лекция 11
- •1.Технология связанного азота
- •2.Синтез аммиака
- •Лекция 12
- •1.Технология азотной кислоты
- •Лекция 14
- •1.Производство метанола
- •2.Синтез этанола
- •Синтез этанола
- •План лекции
- •Производство бутадиена-1,3 дегидрированием н-бутана
- •Производство фенола кумольным методом
Лекция 11
ПЛАН ЛЕКЦИИ
1.Технология связанного азота
2.Синтез аммиака
•В промышленности азот необходим для производства:
• азотных удобрений,
• красителей,
•пластических масс,
•химических волокон,
• взрывчатых веществ, порохов
• Природных соединений азота чрезвычайно мало, практически единственным источником азота на Земле является воздух, содержащий 74% этого элемента.
•Методы фиксации атмосферного азота:
•Соединение азота с кислородом при высокой температуре в пламени электричесой дуги.
•Химическое взаимодействие азота и кислорода - это двусторонняя эндотермическая реакция, протекающая без изменения объема:
![]()
Реакция начинается при температуре -3000 °С, однако выход достигает только нескольких процентов. Широкого распространения он не получил, но в настоящее время возрождается на основе использования плазменных процессов.
Цианамидный метод. Аммиак получают азотированием карбида кальция при 1000 °С:
![]()
а затем
![]()
•Контактный метод. Синтез аммиака из элементов с применением катализатора:
![]()
СИНТЕЗ АММИАКА
•В промышленности синтетический аммиак получают:
• при низком давлении (10 - 15 МПа),
•среднем (30 МПа)
•высоком (100 МПа).
•
•Оптимальный метод синтеза выбирают с учетом физико-химических свойств системы, в основе которой лежат химическая реакция азота и водорода, свойства сырья и получаемого продукта
•
•Синтез аммиака возможен каталитическим способом, при температуре зажигания катализатора (420 - 500 °С) и устойчивой работе катализатора.
•Химико-технологическая система получения аммиака включает несколько химико-технологических процессов:
•получение синтез-газа эквивалентной смеси из природного газа и водяного пара,
•при обработке части парафиновых продуктов водяным паром, а затем другой части - кислородом воздуха, чтобы привлечь азот воздуха к участию в синтез-газе
•Химические превращения при получении синтез-газа:
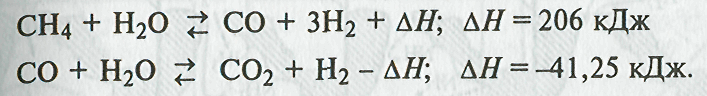
•суммарное уравнение химического взаимодействия при обработке природного газа водяным паром:
![]()
Находящаяся в природном газе часть углеводородов С2 - С4 взаимодействует по общей схеме:
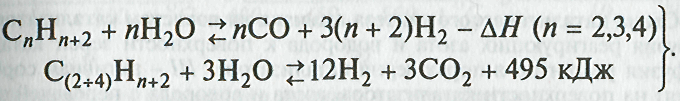
Взаимодействие природного газа с кислородом воздуха происходит по уравнению
![]()
и реализуется на втором этапе конверсии природного газа в синтез-газ при получении аммиака
•В связи с тем что содержание в природном газе тяжелых меркаптанов, сульфидов и дисульфидов в несколько раз превышает допустимое содержание серы в современных высокопроизводительных агрегатах синтеза аммиака применяют двухстадийную сероочистку.
На первой стадии сераорганические соединения гидрируются с использованием алюмокобальтмолибденового или алюмоникельмолибденового катализатора при температуре 350—400 оС и давлении 2-4 МПа. При гидрировании протекают следующие реакции:
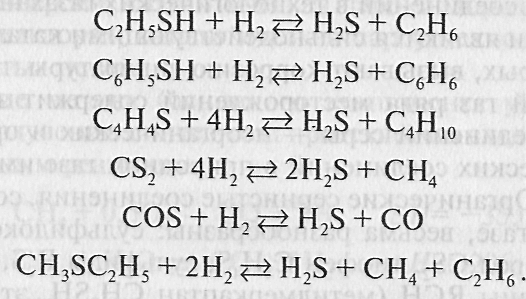
•На второй стадии образовавшийся сероводород при температуре 390- 410 0С поглощается сорбентом на основе оксида цинка .
![]()
При температуре от 200 до 500 °С реакция необратима и можно обеспечить высокую степень очистки газа
Катализаторы конверсии метана.
В промышленных условиях процесс ведут в присутствии катализаторов, которые позволяют не только значительно ускорить реакции конверсии, но и при соответствующем избытке окислителей исключить протекание реакции СН4 С + 2Н2.
Наибольшей каталитической активностью в данном процессе обладают никелевые катализаторы на носителе — глиноземе (Аl2О3).
Никелевые катализаторы процесса конверсии метана выпускают в виде таблетированных и экструдированных колец Рашига.
Так, катализатор марки ГИАП-16 имеет следующий состав: 25% Ni0. 57% Аl2О3, 10% СаО, 8% МgО.
•Срок службы катализаторов конверсии при правильной эксплуатации достигает трех лет и более. Их активность снижается при действии различных каталитических ядов.
•Никелевые катализаторы наиболее чувствительны к действию сернистых соединений. Отравление происходит вследствие образования на поверхности катализатора сульфидов никеля, совершенно неактивных к реакции конверсии метана и его гомологов.
•Отравленный серой катализатор удается почти полностью регенерировать в определенных температурных условиях при подаче в реактор чистого газа. Активность зауглероженного катализатора можно восстановить, обрабатывая его водяным паром.
•В отходящих газах имеются оксиды азота, количество которых в значительной степени зависит от соотношения воздуха и природного газа, а также от объема добавляемых к природному газу танковых и продувочных газов, содержащих аммиак, в определенных условиях превращающийся в оксиды азота
•Отходящие газы аммиачного производства очищают по методу каталитического восстановления при умеренных температурах.
•Восстановителем служит аммиак, с помощью которого происходит восстановление оксидов азота до элементарного азота по следующим реакциям:
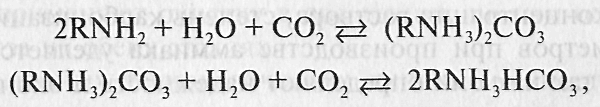
•Восстановление проводят при избыточном содержании аммиака для обеспечения высоких степеней превращения оксидов.
• Для процесса очистки используют алюмованадиевый и алюмомарганцевованадиевый катализаторы,
срок службы которых примерно 5 лет. Необходимо достаточно точно регулировать температуру процесса (180— 320 °С)
•Синтез аммиака - циклический процесс, позволяющий возвращать непрореагировавшую азотоводородную смесь в производство после выделения из нее образовавшегося аммиака
•Большие объемные скорости, соблюдение оптимального температурного режима, применение азотоводородной смеси высокой степени чистоты и активных пористых катализаторов обеспечивают большую производительность установки по получению аммиака
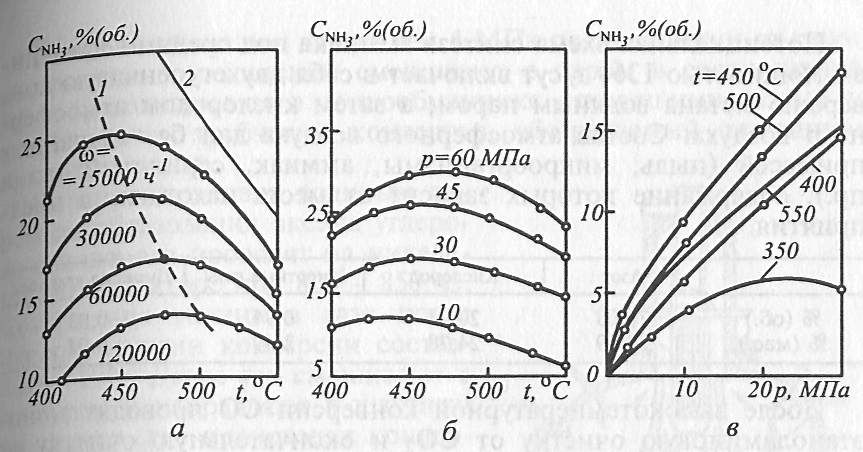
Зависимость содержания аммиака от температуры:
а - при разных объемных скоростях (Р = 30 МПа); б - при разных давлениях (объемная скорость 30000 ч'1); в - от давления при разных температурах (объемная скорость 30000 ч"1)
•Катализаторы синтеза аммиака
•Высокую каталитическую активность в процессе синтеза аммиака проявляют металлы VI, VII и VIII групп периодической системы. Наибольшей активностью обладают Fе, Ru, Re, Оs.
•В промышленности нашли применение
железные катализаторы, получаемые сплавлением оксидов железа с активаторами (промоторами) и последующим восстановлением оксидов железа.
В качестве активаторов применяют оксиды кислотного и амфотерного характера — Аl2О3, SiO2, TiO2 и др., а также оксиды щелочных и щелочно-земельных металлов — К20, Nа2О, СаО, МgО и др.
•Процесс восстановления катализатора можно описать суммарным уравнением
![]()
•В современном агрегате синтез аммиака ведут при температуре 420 - 500 °С и давлении 32 МПа; объемная скорость 25 103 ч -1;
•схема синтеза аммиака под средним давлением включает в себя двухступенчатую конверсию метана водяным паром, а затем кислородом атмосферного воздуха

После высокотемпературной конверсии СО проводят моноэтаноламиновую очистку от СО2 и окончательную очистку от СО и СО2 каталитическим гидрированием (метанированием).
Далее идет синтез аммиака, его отделение от синтез-газа, для снижения содержания инертных примесей и метана в синтез-газе до 14 - 18%.
Синтез-газ после первичной конверсии подвергают продувке. Из продувочных газов выделяют аммиак, а продувочные газы в смеси с танковыми направляют на сжигание в блок конверсии метана. Схема движения потоков в ХТС синтеза аммиака представлена на рис.
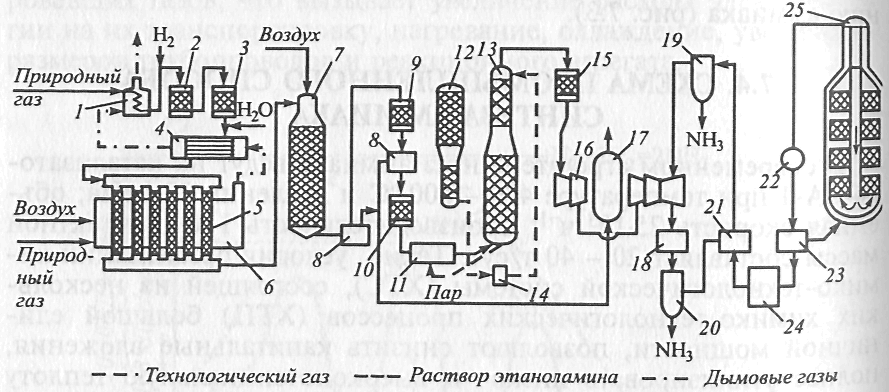

•Природный газ под давлением 4 МПа после очистки от серосодержащих соединений смешивают с паром в соотношении 3,7 : 1, подогревают в теплообменнике отходящими газами и направляют в трубчатый конвертор, обогреваемый сжиганием природного газа.
•Конверсию метана водяным паром до образования оксида углерода и водорода проводят на никелевом катализаторе при 800 - 850 °С
•Далее происходит конверсия метана кислородом воздуха при 900 - 1000 °С и соотношении воздух : газ = 0,8 : 1.
• Из шахтного конвертора газ поступает в котел-утилизатор, где получают пар высоких параметров (10 МПа и 480 °С), направляемый в турбины центробежных компрессора и насоса высокого давления.
• Из котла-утилизатора синтез-газ поступает на двухступенчатую конверсию оксида углерода - сначала в конверторе первой ступени на среднетем-пературном железохромовом катализаторе при температуре 430 -470 °С, а затем в конверторе второй ступени на низкотемпературном цинкхромомедном катализаторе при 200 - 260 °С.
•Между первой и второй ступенями конверсии установлен котел-утилизатор.
•скруббер, орошаемый раствором моноэтаноламина, где при 30 - 40 °С происходит очистка газа от СО2
•Содержание аммиака в оборотной азотоводородной смеси при давлении 30 МПа и температуре -5 °С составляет -2,5%.
•Основной аппарат агрегата синтеза аммиака - колонна синтеза
•Колонна представляет собой цилиндр высотой около 32 м и диаметром 2,4 м,
•Основной поток газа поступает в колонну снизу, проходит по кольцевой щели между корпусом колонны и кожухом катализаторной коробки 3 и поступает в межтрубное пространство теплообменника 6. Синтез-газ нагревается конвертированным газом до 420 - 440 °С и проходит последовательно четыре слоя катализатора, между которыми подается холодный байпасный газ. После четвертого слоя катализатора газовая смесь при 500 - 575 °С поднимается по центральной трубе 2, проходит по трубкам теплообменника 6, охлаждаясь до 320 -350 °С, и выходит из колонны.
ВЫВОДЫ
1.Промышленные технологии ситнтеза аммиака подразделяются
на процессы при низком, среднем и высоком давлениях
2.Исходным сырьем является водород, получаемый из синтез-газа,
и азот, получаемый из воздуха криогенным способом
3.Катализаторм синтеза аммиака является железо, промотированное
оксидами щелочных и щелочноземельных металлов, а также
оксидами алюминия, кремния и титана
