
- •В химическом производстве. План лекции
- •1.Введение. 2.Химическое производство
- •3.Иерархическая организация процессов в химическом производстве. 3.Классификации и категории эффективности химических производств.
- •Эффективности химических производств План лекции
- •План лекции
- •1.Сырье
- •2. Классификация химического сырья
- •3. Подготовка химического сырья к переработке
- •Классификация химического сырья
- •План лекции
- •Виды использования вторичных энергетических ресурсов
- •План лекции
- •Виды типовых технологических операторов хтс
- •Классификация и условные изображения типовых технологических операторов хтс
- •Понятие идентификации хтс план лекции
- •Понятия анализа, оптимизации и синтеза хтс
- •Лекция 7 Эксергетический баланс. Классификация химических реакторов план лекции
- •Классификация химических реакторов
- •Для реализации нулевого порядка из уравнения получают
- •Уравнение материального баланса для рис-н
- •Лекция 5
- •Реактор идеального вытеснения (рив)
- •Сравнение эффективности проточных реакторов идеального смешения и идеальног вытеснения
- •Модели реакторов с неидеалной структурой потоков
- •Скорость простой необратимой реакции n-го порядка
- •Сравнение эффективности хтп при использовании
- •Модели реакторов с неидеалной структурой потоков
- •Реакторы с различным тепловым режимом
- •Лекция 6
- •Тепловая устойчивость химических реакторов
- •Лекция 7
- •1.Гетерогенные некаталитические процессы
- •2.Лимитирующая стадия. Способы определения лимитирующей стадии
- •3.Кинетические модели системы газ - твердое вещество
- •Кинетические модели гетерогенных процессов в системе «газ- твердое вещество».
- •Внешняя диффузия. В результате протекания химической реакции
- •Константа скорости гетерогенного процесса. Лимитирующая стадия
- •Лекция 8
- •1.Лимитирующая стадия – внутренняя диффузия (газ- твердое)
- •2.Способы определения лимитирующей стадии
- •3.Гетерогенные процессы «газ- жидкость»
- •Гетерогенные процессы «газ—жидкость»
- •Массопередача между газом и жидкостью
- •Кинетические модели газожидкостных реакций
- •Лекция 9
- •1.Общие представления о катализе
- •2.Технологические характеристики твердых катализаторов
- •3.Стадийность гетерогенно каталитических процессов
- •Технологические характеристики твердых катализаторов
- •Лекция 10
- •Промышленные химико-технологические процессы
- •Классификация сточных вод
- •Лекция 11
- •1.Технология связанного азота
- •2.Синтез аммиака
- •Лекция 12
- •1.Технология азотной кислоты
- •Лекция 14
- •1.Производство метанола
- •2.Синтез этанола
- •Синтез этанола
- •План лекции
- •Производство бутадиена-1,3 дегидрированием н-бутана
- •Производство фенола кумольным методом
Технологические характеристики твердых катализаторов
Подбор катализаторов для проведения промышленных процессов — задача чрезвычайно сложная. Катализаторы очень специфичны по отношению к различным химическим реакциям. Существующие теории катализа объясняют эту специфичность рядом энергетических и геометрических факторов, в результате влияния которых данный катализатор воздействует на скорость только одной реакции или очень узкой группы реакций. Не всегда еще возможен строгий научный выбор конкретного катализатора для данного химико-технологического процесса, хотя теория каталитических процессов в последние десятилетия получила значительное развитие и характеризуется многими новыми достижениями.
Твердые катализаторы — это, как правило, высокопористые вещества с развитой внутренней поверхностью, характеризующиеся определенной пористой и кристаллической структурой, активностью, селективностью и рядом других технологических характеристик.
Рассмотрим некоторые характеристики твердых катализаторов.
•Температура зажигания — это минимальная температура, при которой технологический процесс начинает идти с достаточной для практических целей скоростью.
•Селективностью или избирательностью катализатора называют его способность избирательно ускорять целевую реакцию при наличии нескольких побочных.
•Селективность зависит не только от выбранного катализатора, но и от условий проведения процесса, области протекания гетерогенно-каталитического процесса (кинетической, внешне- или внутреннедиффузионной) и т. д.
Пористая структура характеризуется размерами и формой пор, пористостью (отношением свободного объема пор к общему объему), удельной поверхностью катализатора
Распределение пор по размерам может оказаться таким, что часть поверхности катализатора окажется недоступной для реагирующих молекул большого размера и, кроме того, скорость превращения реагентов в конечные продукты может уменьшаться вследствие затруднения диффузии реагентов внутри пор.
Промотирование и отравление катализаторов. Часто введение очень небольшого количества (долей процента) какой-либо посторонней добавки к. основному катализатору приводит либо к резкому повышению его активности, либо, наоборот, к снижению активности на несколько порядков. В первом случае говорят о промотировании, во втором — об отравлении катализатора
Добавки могут вступать с основным катализатором в химическое взаимодействие, образуя на поверхности продукты, обладающие более высокой каталитической активностью. Они могут изменить условия взаимодействия с реагентами в местах контакта основного компонента и промотора, а также увеличить дисперсность или стабилизировать пористую и кристаллическую структуру катализатора
1-я стадия - диффузия реагента к внешней поверхности катализатора. Эта стадия назвается стадией внешней диффузии
2-я стадия - диффузия внутри пор катализатора (стадия внутренней диффузии).
3-я стадия – адсорбция. Различают физическую адсорбцию и хемосорбцию. При хемосорбции молекулы адсорбата образуют поверхностные соединения с адсорбентом.
4-я стадия- химическая реакция, механизм этой реакции может быть различным, от него зависит вид кинетического уравнения. В результате поверхностной реакции образуется адсорбированный продукт.
5-я стадия - десорбция продукта с поверхности катализатора.
6-я стадия. - диффузия из пор к внешней поверхности катализатора
7-я стадия. - диффузия от поверхности катализатора
Стадии 3, 4, 5 являются центральными в ходе каталитического процесса. Суммарно их можно рассматривать как поверхностную химическую реакцию. Эти стадии могут протекать одновременно с предыдущими — диффузионными — стадиями, причем как на внешней поверхности зерна катализатора, так и, в основном, на внутренней поверхности пор.
6-я стадия. Десорбированные газообразные продукты диффундируют из пор к внешней поверхности катализатора (обратная внутренняя диффузия).
7-я стадия. Газообразные продукты диффундируют от поверхности катализатора в тазовый поток через пограничную пленку, окружающую зерно катализатора.
Таким образом, гетерогенно-каталитический процесс — это сложная система последовательных и параллельных стадий, имеющих разную природу. Как и в случае некаталитического гетерогенного процесса, одна из стадий может оказывать наиболее сильное тормозящее воздействие на весь процесс, тогда скорости остальных стадий «подстраиваются» под скорость этой наиболее затрудненной стадии, которая может быть названа лимитирующей.
Влияние массопередачи через газовую фазу. Исходные реагенты до адсорбции и продукты реакции после десорбции должны транспортироваться из газового потока к поверхности катализатора или от нее в газовый поток. Если реакция происходит в проточной системе, скорость газа обычно достаточно велика, чтобы массопе-редача происходила по механизму турбулентной диффузии. При этом общая скорость процесса не зависит или зависит слабо от скорости внешней диффузии. При нетурбулентном течении газа скорость массопередачи может быть относительно низкой, возможно внешнедиффузионное торможение каталитической реакции, нежелательное при проведении процесса в промышленном реакторе.
Каталитический процесс протекает во внешнедиффузионной области при большом диаметре зерен катализатора, малой линейной скорости газа относительно катализатора и очень высоких температурах.
При этом концентрация реагентов сД5 и продуктов сКк у внешней поверхности катализатора резко отличается от концентраций
в газовом потоке.
Внешнедиффузионное торможение каталитической реакции нежелательно в промышленном реакторе.При этом концентрация реагентов и продуктов у внешней поверхности катализатора резко отличается от концентрации в объеме реакционной смеси
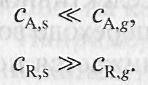
ВЫВОДЫ
1.Активность катализатора – мера ускоряющего действия по
отношению к данной реакции
2.Каталитические процессы подразделяют на гомогенные и
гетерогенные
3.Добавки, повышающие активность катализаторов называются
промоторами, а понижающие ее - ядами
