
- •В химическом производстве. План лекции
- •1.Введение. 2.Химическое производство
- •3.Иерархическая организация процессов в химическом производстве. 3.Классификации и категории эффективности химических производств.
- •Эффективности химических производств План лекции
- •План лекции
- •1.Сырье
- •2. Классификация химического сырья
- •3. Подготовка химического сырья к переработке
- •Классификация химического сырья
- •План лекции
- •Виды использования вторичных энергетических ресурсов
- •План лекции
- •Виды типовых технологических операторов хтс
- •Классификация и условные изображения типовых технологических операторов хтс
- •Понятие идентификации хтс план лекции
- •Понятия анализа, оптимизации и синтеза хтс
- •Лекция 7 Эксергетический баланс. Классификация химических реакторов план лекции
- •Классификация химических реакторов
- •Для реализации нулевого порядка из уравнения получают
- •Уравнение материального баланса для рис-н
- •Лекция 5
- •Реактор идеального вытеснения (рив)
- •Сравнение эффективности проточных реакторов идеального смешения и идеальног вытеснения
- •Модели реакторов с неидеалной структурой потоков
- •Скорость простой необратимой реакции n-го порядка
- •Сравнение эффективности хтп при использовании
- •Модели реакторов с неидеалной структурой потоков
- •Реакторы с различным тепловым режимом
- •Лекция 6
- •Тепловая устойчивость химических реакторов
- •Лекция 7
- •1.Гетерогенные некаталитические процессы
- •2.Лимитирующая стадия. Способы определения лимитирующей стадии
- •3.Кинетические модели системы газ - твердое вещество
- •Кинетические модели гетерогенных процессов в системе «газ- твердое вещество».
- •Внешняя диффузия. В результате протекания химической реакции
- •Константа скорости гетерогенного процесса. Лимитирующая стадия
- •Лекция 8
- •1.Лимитирующая стадия – внутренняя диффузия (газ- твердое)
- •2.Способы определения лимитирующей стадии
- •3.Гетерогенные процессы «газ- жидкость»
- •Гетерогенные процессы «газ—жидкость»
- •Массопередача между газом и жидкостью
- •Кинетические модели газожидкостных реакций
- •Лекция 9
- •1.Общие представления о катализе
- •2.Технологические характеристики твердых катализаторов
- •3.Стадийность гетерогенно каталитических процессов
- •Технологические характеристики твердых катализаторов
- •Лекция 10
- •Промышленные химико-технологические процессы
- •Классификация сточных вод
- •Лекция 11
- •1.Технология связанного азота
- •2.Синтез аммиака
- •Лекция 12
- •1.Технология азотной кислоты
- •Лекция 14
- •1.Производство метанола
- •2.Синтез этанола
- •Синтез этанола
- •План лекции
- •Производство бутадиена-1,3 дегидрированием н-бутана
- •Производство фенола кумольным методом
Внешняя диффузия. В результате протекания химической реакции

Концентрация газообразного реагента А у поверхности твердой частицы ниже, чем в ядре газового потока
Суммарный перенос вещества вследствие молекулярной диффузии и конвективного переноса называется конвективной диффузией.
Процесс конвективной диффузии может быть описан дифференциальным уравнением
(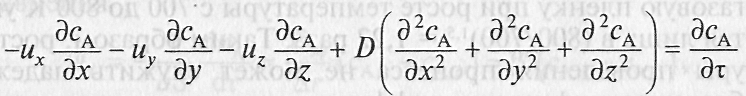 7)
7)
или в более краткой записи:
(![]() 8)
8)
Где ux, uY, uZ— линейные скорости потока в направлении осей соответственно х, у, z.
Для определения скорости конвективной диффузии пользуются уравнением

(9)
где Wk— скорость конвективной диффузии, т. е. количество газообразного реагента А, перенесенное вследствие конвективной диффузии через единицу поверхности в единицу времени; ( — коэффициент массоотдачи, зависящий от гидродинамики потока.
Принимают, что у поверхности твердой частицы существует неподвижный диффузионный подслой толщиной , внутри которого перенос вещества осуществляется исключительно вследствие молекулярной диффузии. Скорость внешней диффузии (конвективной) через реальную газовую пленку толщиной можно приравнять тогда скорости молекулярной диффузии через диффузионный подслой толщиной 1 . В соответствии с уравнением
![]()
(10)
где D — коэффициент молекулярной диффузии.
Внутренняя диффузия. Если в результате гетерогенного взаимодействия газообразного и твердого реагентов наряду с газообразными образуются и твердые продукты реакции, стадией, предшествующей собственно химической реакции и следующей за внешней диффузией, будет стадия внутренней диффузии — проникновения газообразного реагента через слой твердых продуктов реакции к поверхности ядра, на которой осуществляется химическое взаимодействие.
Скорость внутренней диффузии
(![]() 11)
11)
где Dэф — эффективный коэффициент диффузии, учитывающий пористость твердого вещества, извилистость пор и т. д.
Если толщина слоя золы невелика, можно считать, что
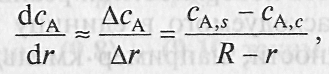
(12)
где R — внешний радиус твердой частицы — постоянная величина в рамках рассматриваемого случая частицы с неизменяющимися внешними размерами; r— радиус ядра, уменьшающийся по мере протекания процесса.
Тогда скорость внутренней диффузии можно представить в виде уравнения
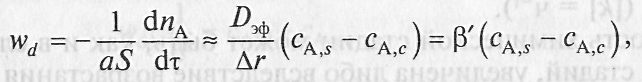
(13)
Поверхностная химическая реакция.
Скорость поверхностной реакции может быть описана законами химической кинетики

(14)
где ks — константа скорости поверхностной химической реакции;
п — порядок реакции.
Константа скорости гетерогенного процесса. Лимитирующая стадия
Скорость гетерогенного процесса по аналогии с законом действующих масс можно выразить как произведение некоторой константы скорости К на концентрацию газообразного реагента в газовом потоке САg:
![]()
(15)
Уравнения скоростей отдельных стадий:
![]()
(16)
![]()
(17)
![]()
(18)
Представим уравнения (16) - (18) таким образом, чтобы в их правых частях остались только концентрации реагентов, а затем почленно сложим их с учетом того, что в стационарных условиях
![]()
(19)
![]()
![]()
![]()
_![]() ___________________________________________________________
(20)
___________________________________________________________
(20)
П олучаем:
олучаем:
(21)
Таким образом, скорость гетерогенного процесса представлена в виде произведения константы скорости гетерогенного процесса К на концентрацию реагента А в газовой фазе Саg .
Когда сопротивление одной из стадий существенно превышает сопротивление двух других стадий, т, е. одна стадия затруднена по сравнению с другими, константа скорости гетерогенного процесса с достаточно хорошим приближением будет равна коэффициенту интенсивности данной стадии. Например;
![]()
![]()
(22)
Если такая затрудненная стадия существует, ее называют лимитирующей.
Процесс лимитируется внешней диффузией.
Основное сопротивление сосредоточено на стадии проникновения газообразного реагента А через пограничную газовую пленку, обедненную этим реагентом. Скорость гетерогенного процесса, равная в этом случае скорости конвективной диффузии, определяется уравнением:

(23)
Так как концентрация СA,S реагента А на поверхности твердой частицы равна нулю:

(24)
Скорость гетерогенной реакции можно выразить через изменение во времени количеств газообразного реагента А и твердого реагента В:
( 25)
25)
Количество реагента В в твердой частице можно представить как произведение объема ядра Vв на молярно-объемную плотность dnB
Тогда
![]()
(26)
Поверхность S, к которой отнесена скорость внешней диффузии,— это внешняя поверхность твердой частицы с радиусом R:
![]()
(27)
Подставляя dnB из уравнения (26) и S из уравнения (27) в уравнение (25), получим

(28)
Р ешим
дифференциальное уравнение (28) при
начальном условии r
= R,
если
= 0:
ешим
дифференциальное уравнение (28) при
начальном условии r
= R,
если
= 0:
(29)
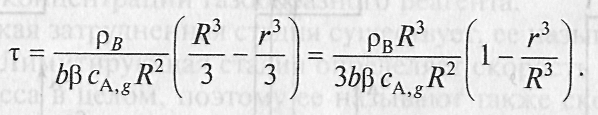
(30)
Отношение г3/R3 можно заменить на отношение объема к объему всей твердой частицы (VB/V0) и, умножив числитель и знаменатель на В , получим:

(31)
где V0 — полный объем твердой частицы неменяющихся размеров.
С учетом формулы (31)
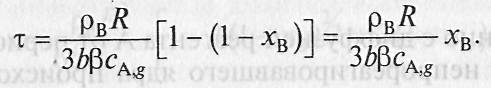
(32)
При XB = 1 (весь реагент В прореагировал) уравнение (32) позволит определить время полного превращения твердой частицы Вn, если гетерогенный процесс лимитируется внешней диффузией:

(33)
Следовательно, для внешнедиффузионной области протекания гетерогенного процесса зависимость между и X B имеет линейный характер:
![]()
(34)
ВЫВОДЫ
1.Гетерогенные процессы протекают на поверхности раздела фаз.
Скорость всего процесса определяется скоростью самой медленной
стадии, которая называется лимитирующей стадией
2.Скорость гетерогенного процесса зависит от скоростей химической
реакции и скоростей диффузионных стадий
3.При описании гетерогенных процессов в системе «газ – твердое
вещество» используют две модели: квазигомогенная модель и
модель с фронтальным перемещением зоны реакции
